МИНИСТЕРСТВО НЕФТЯНОЙ промышленности ВСЕСОЮЗНЫЙ НЕФТЕГАЗОВЫЙ НАУЧНО-ИССЛВД)ВАТЕЛЬСКИИ институт (ВНИИ)
ГЛЕТОДИКА РАСЧЕТА НОШ РАСХОДА 1ЛЕТАНОЛА Д1Ш БОРЬБЫ С ПЩРАТООБРАЗОВАНИЯГкСП
РД 39-1-212-79
МИНИСТЕРСТВО НИТЯНОЙ ЩШИШ1КННОСТИ ВСЕСОЮЗНЫЙ НЮТЕГАЭОВЫЙ НАУЧНСЫКХУЩВОВАТЕЯЬСИЙ ИНСППУТ (ВНИИ)
|
Заместитель нефтяной |
|
/А.В.Валихаяов |
утвЕрдаю/2" шаля! 1979 г.
МЕТОДИКА РАСЧЕТА НОРМ РАСХОДА МЕТАНОЛА ДЛЯ БОРЬБЫ С ВДРАТООБРАЗОВАНИЯМИ
РД 39-I-2I2-79
1979 г,
Метанол смввивается во всех отношениях с многими органическими соединениями я более чем со 100 из них образует азеотропные смеси, в частности, о ацетоном (содержание метанола - 12%, температура пиления 55,7°С), сероуглеродом (14^, 37,65°С) четыреххлористым углеродом (20,66^; 55,7°С), бензолом (39,#; 67,5°С), циклогексаном (61,0£; 54,2°С).
При сжигании на воздухе парообразного метанола происходит реакция.
2cuj он+Зог +ъ-7,чг ыг:гсог * гг,56
Горит метанол слабо-голубым несветящимся пламенем.
Метанол сочетает свойства слабого основания и еще более слабой кислоты, что обусловлено наличием алкильной и гидроксильной групп. На воздухе метанол окисляется последовательно до формальдегида, муравьиной кислоты и двуокиси углерода по схеме:
си3о//~—— нс но нс new --Q+ С0г
Основной способ получения метанола - синтез из водорода ж окиси углерода. Исходным сырьем служит коксовый, природный ж другие углеводородные газы. Синтезированный метанол-сырец содержит 89-9# СНдОН днметилового эфира и от 6 до 9% воды, высших спжртов я других примесей. Дальнейшей ректификацией получают метанол с концентрацией 99,9?с
К ньд&статкам метанола относится то, что при сравнительно невысокой цене □рактичесгн весь метанол теряется после однократного использования из-за того, что отсутствуют установки по
регенерапия, а также из-за дополнительных безвозвратных потерь на унос с газом и растворения в конденсате.
Расчет норм расхода метанола необходимо производить для каждого конкретного случая отдельно, в зависимости от условий гидратообразования: давления Р, температуры't и влажности газа W.
Примечание:
Не исключается возможность укрупненных расчетов. Например, несколько скважин с близкими значениями, Р, Т и W могут быть объединены в одну группу с осреднеиными параметрами. Допускается также осреднение параметров газосборной сети. При этом следует учитывать, что предельные колебания осредненных величин не должны превышать 10$.
Для легколетучего ингибитора гидратообразования, каким является метанол, удельная норма расхода его складывается из количества метанола, необходимого для насыщения жидкой свободной) воды - (I* » и количества метанола необходимого для насы-
\у, - влажность газа в начале участка, на котором образуются гтщраты кг/1000 м°;
NA- влажность газа в конце участка, яа котором образуются идраты, кг/1000 м3;
С. - весовая концентрация вводимого (свежего) метанола,$;
Q - весовая концентрация метанола в воде (концентрация от-раоотаиного метанола в конце участка, на котором образуются гидраты), %;
^ - отношение содержания метанола, необходимого для насыщения газа,к концентрации метанола в жидкости, (
Для определения суточного расхода метанола следует
удельную норму умножить на суточный расход обрабатываемо-
(в тыс.ы3/сут), т.е.
(3)
Для пересчета расхода из кг/сут.в л/сут. следует по табд.З определить плотность впрыскиваемого раствора метанола при соответствующей температуре, а затем разделив расход, полученный по формуле (3) на эту плотность, получим расход метанола в л/сут.
Для определения удельной нормы расхода метанола, как это следует иэ формулы (2), необходимо знать влажность газа и концентрацию метанола в двух точках: в начале и в конце участка, на котором образуются гидраты (например, на забои и в конце ■лейфа; после сепараторов первой и последней степени сепарации к т.д.).
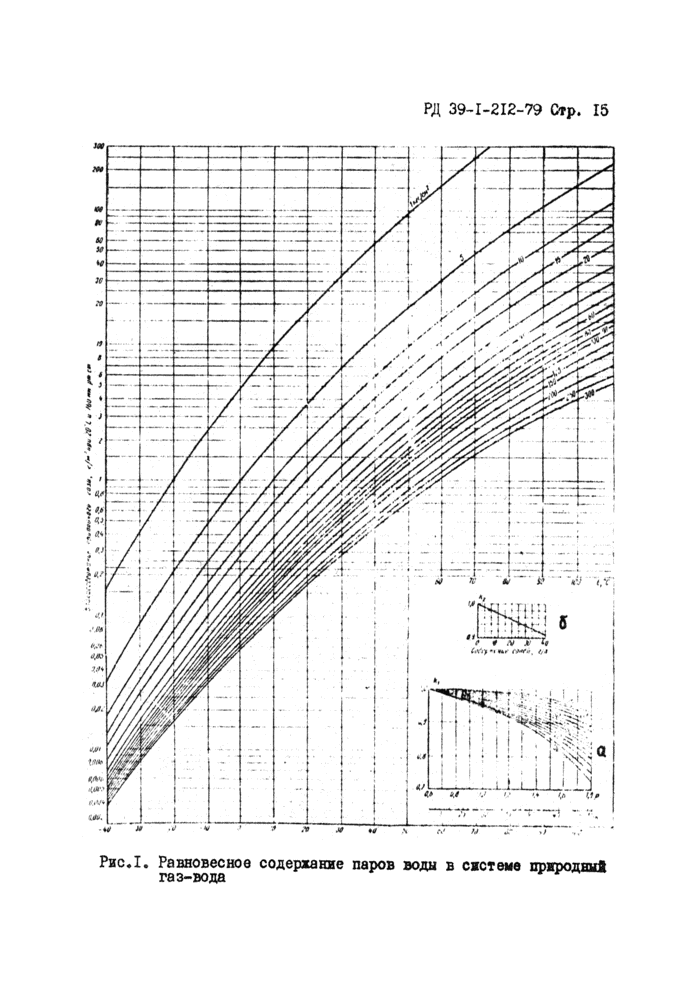
Влажность углеводородных газов о относительной плотностью (по воздуху) 0,6, не содержащих азот и насыщенных пресной водой при раалжчнрх температурах и давлениях можно определить по графикам, составленным по экспериментальным данным, аналогично приводе кисму на рис Л.
Влажность газа зависят от углеводородного состава его, нем больше в газе тяжелых углеводородов, тем ниже его влажность* Наличие HgS и С02 увеличивает влажность rasa, а азота - уменьшает её.
Для определения влажности газа, относительная плотность которого отличается от 0,6 необходимо ввести поправку на плот-рость Kj (см.рисЛа)
где W , Wo;6 ~ влажность исследуемого газа ж газа с плотностью 0,6 соответственно, с2A2SJ?**? .» гр ъЛлГР
Наличие в v растворенных солей ( Псг^С, мдр.)
снижает парциальное давление паров воды над раствором, а следовательно, и влажность рввновеиного о ним газа.
Поправочный коэффициент на соленость Kg приведен на рис.15 и определяется отношением
VVc
W
где Wc - равновесная влажность газа, находящегося в контакте с водой, содержащей соли.
Влажность газа определяют в кг/1000 мэ.
Пример I.
Нефтяной газ с относительной плотностью 0,9 находится в контакте с пластовой водой, содержащей 35 г/л л/aOtI Давление газа 31 кгс/см2, температура 50°С. Определить влажность
газа при этих условиях
Решение,
Согласно графика рисЛ при давлении 31 кгс/см^ и температуре 50^ содержание влаги в газе равно 3,5 г/н3{кг/1000 м3).
Поправка на плотность (см.рис,1а) для газа с относительной плотностью 0,9 при 50°С равна Kj = 0,98, а поправка на соленость согласно рис.16 равна Kg * 0,92.
Тогда
W'-W,i6- К,К2:3,5 0,98 0,92 ’ 3, |5 к//о00м3
Определив по графику рис.1 влажность газа в начале W, ж в конце участка, на котором образуются гидраты, находят
количество влаги, выделяющейся из каждых 1000 м3 проходящего газа (в кг):
aW-W,-4
(6)
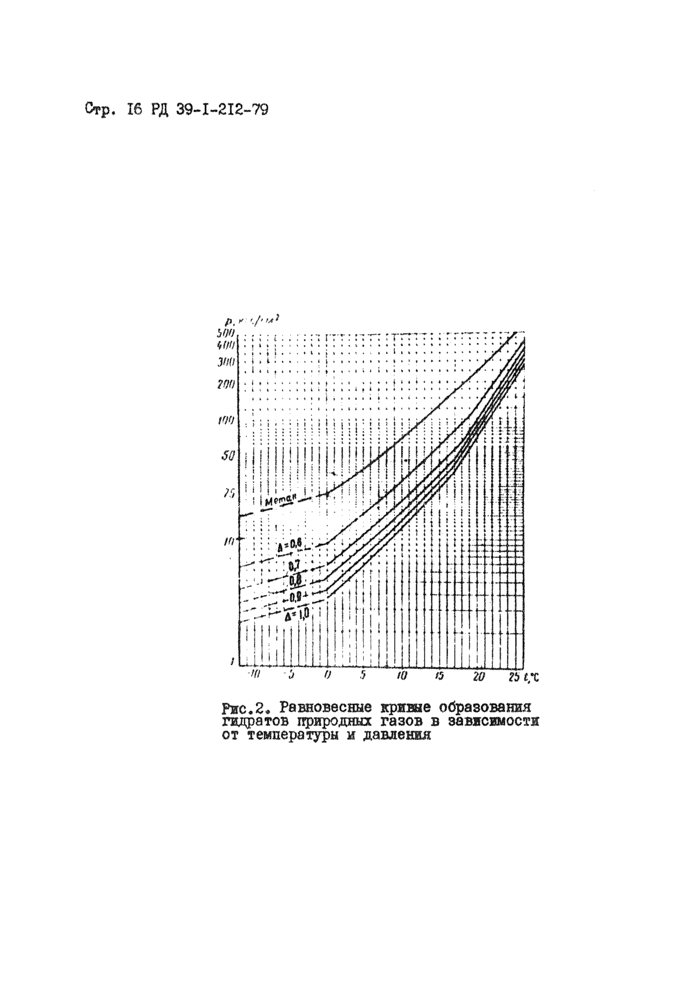
Определяют равновесную температуру гддратообразования!^^^ Наиболее правильным считается определение температуры гид-ратообразования по экспериментальным данным. Если экспериментальные данные отсутствуют, то для определения температуры гидрато-
образования ■£ следует пользоваться равновесными кривыми
1 идр.
образования гидратов газов различной плотности, приведенными на рис.2.
Зная температуру газа в конце участка, на котором образуются гидраты tz °С (измеряется или рассчитывается) определяют величину снижения равновесной температуры, необходимой для предотвращения гидратообразования:
|
|
Рис.2. Равновесные кривые образования гидратов природных газов в зависимости от температуры и давления |
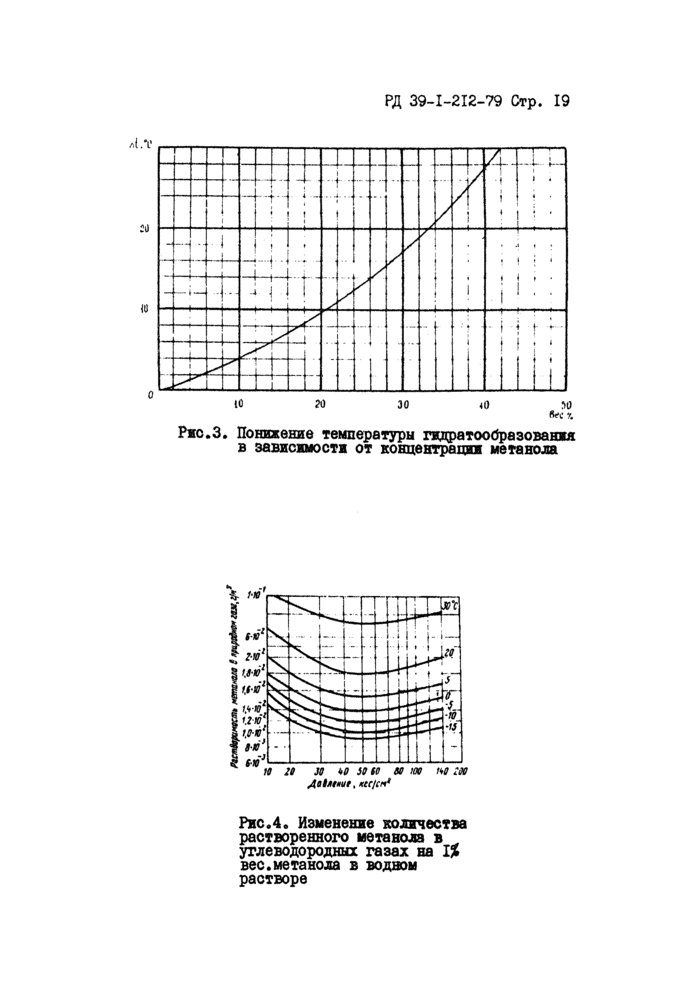
После определения л £ по графику рис.З находят концентрацию растворенного в воде (отработанного) метанола С2 в процентах.
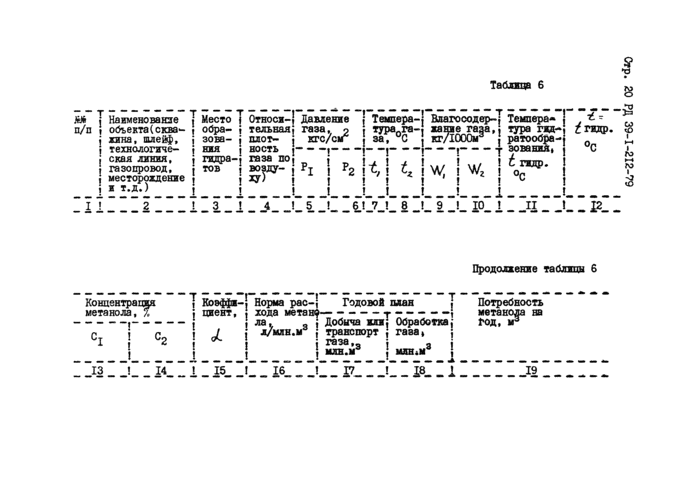
Коэффициент , являющийся отношением концентрации метанола в паровой фазе к концентрации отработанного метанола в жидкой
фазе, для конечного давления Р? и температуры I определяют по
А z
графику, приведенному на рис.4.
Таким образом, становятся известными все величины, входящие в формулу (2), подставлял которые определяют норму расхода метанола непосредственно на технологический процесс -
Норму расхода метанола на технологический процесс необходи-
п
мо увеличить но величину потерь д QM% которая складывается из:
1. потерь на неравномерность подачи, величина которых по опытно-статистическим данным составляет порядка 0,0517 кг/ЮООм3 газа;
2. потерь от утечек, величина которых по данным проектных и исследовательских организаций составляет порядка
0,010 кг/1000 м3;.
3. потерь от испарения в резервуарах, величина которых по опытно-статистическим данным составляет порядка 0,003 кг/1000 м\
Таким образом, оощая норма расхода метанола:
Нормы расхода метанола должны рассчитываться отдельно для каждого объекта или для группы объектов (если возможно группирование объектов). Средние нормы по производственным единицам или объединениям формируются как средневзвешенные по индивидуальным нормам для отдельных объектов:
(8)
норма расхода метанола по предприятию, объединению; индивидуальная норма расхода метанола для обработки газа по L -ому объекту или группе объектов; объем обрабатываемого газа по I -ому объекту или группе объектов;
г) - количество объектов на предприятии или объединении.
Пример 2.
Определить количество метанола, необходимого для предотвращения гидратообразования в стволе скважины и шлейфе при следующих условиях:пластовое давление Р=200кгс/см^,пластовая темпе-
IWc у.
Ржс.З. Понижение температуры гидратообразованжя в зависимости от концентрации метанола
|
ГС 28 JC ЬО 30 it Ов ЮО tsQ :M |
|
|
Aohtmt, Ktc/cn*
Рис.4. Изменение количества растворенного метанола в углеводородных газах на 1% вес.метанола в водном растворе |
АННОТАЦИЯ
В настоящей методике приведены структуры гидратов углеводородных газов, условия Их образования и способы борьбы с ними. Описаны физико-химические свойства метилового спирта (метанола), как одного из ингибиторов гидратообраэования. Изложена методика расчета норм расхода метанола для борьбы с гидратообразойанием при добыче и транспорте природного и нефтяного газа. Приведены примеры расчета норм расхода метанола.
Авторы: Гусев В.И., Арутюнов А.И., Корчажкин М.Т.,
Динабург Л.С.
§
; Наименовакзе Т Место Т Относж-! даме яле ; Темпера-; Вдагосодер-; Темпара-
I объекта(сквв- | обра- i тельная; газа. 2 турапга-{ ханже газа,; тура гта-
j хана, шлейф, j зова- j плот- j кгс/cir за, С кг/ЮССи ратообра-
, ——---- j гидра-, газа по. , _ , , ,
| газопровод. j тов j вояду- j *i j Pg \Ч !
f месторождение , ! **' ! ! I
■ *.*•)___1___X____!___I___!
i.i-i-J-J-& J-.lL7J.fi J-i-L JP-1--Л -J-.R.
|
Концентрация метанола, 1. |
|
|
1 |
Годовой план
Добыча или! Обработка транспорт ; газа,
Е!2®лз i ___з
Потребность метанола на год, М3^
1 _ 15_ _!_ _ 16___!_ _ J7.
.L _ 18.
РУКОВОДЯЩИЙ ДОКУМЕНТ
МЕТОДИКА РАСЧЕТА НОРМ РАСХОДА МШМОЦ ДЛЯ БОРЬБЫ С ПЩРАТООБРАЗОВШШб
РД 39-1 212-79
Приказом Министерства нефтяной промьпиленности от 20.08.79 № 412
Срок введения установлен с I ноября 1979 г.
Срок действия до I ноября 1982 г.
I. НОРМЫ РАСХОДА МЕТАНОЛА ДЛЯ БОРЬБЫ С ГИДРАТ00БРА30ВАНИЯМИ
В связи с интенсивным освоением газовых, газоконденсатных и нефтяных месторождений районов Сибири и Крайнего Севера задача борьбы с гидратообразованием при добыче и транспортировке продукции скважин становится актуальной.
Гидратами углеводородных газов называют твердые кристаллические вещества, образованные ассоциированными молекулами углеводородов и воды с плотностью 0,88-0,9 г/см3, внешне они напоминают мокрый снег.
Рентгенографически установлены два 'типа кристаллической решетки гидратов: структура I, построенная из 46 молекул води и имеющая 8 полостей и структура Л - 136 коле:у., воде, Гб малых полостей и 8 больших.
Молекулы газа-гидратообразователя находится в полостях
Стр. 4 РД 39-I-2I2-79 решетки, которая может существовать только прж наличии этих молекул.
Метан, этан, углекислый газ, сероводород и азот образуют гидраты структуры I, причем идеальная форма полностью насыщенного газом гидрата в этом случае будет (или М*5,75Н20),
где II - молекула гнцратообразователя.
Пропан и изобутан образуют гидраты структуры П с идеальной формулой 8M.I36H20(M‘I7H20).
При добыче и транспорте природного и нефтяного гаэов, которые предотавллют собой смесь различных углеводородных компонентов, образуются смешанные гидраты типа: Сз^гСНц^ГЛ^О, т.е. малые полости в решетке структуры П занимает газ, самостоятельно образующий гидраты структуры I.
Гидраты образуются на поверхности контакта газ-вода. С уменьшением давления и плотности газа, температура гидратообраво ванжя уменьшается.
Для предупреждения образования гидратов в потоке rasa необходимо устранить хотя бы одно из основных условий существования гидратов: высокое давление, низкую температуру или свободную влагу. На сегодняшний день наиболее распространенным методом борьбы с гидратами является применение различных ингибиторов.
В настоящее время наиболее широко применяешь ингибитором для борьбы о гидратообразованием является метанол, обладающий высокой степенью понижения температуры гидратообразования, способностью быстро разлагать уже образовавшиеся гидратные пробки и смешиваться с водой в любых соотношениях, малой вязкостью и низкой температурой замерзания.
виях (0°С, I кгс/см2) представлены ниже:
Метанол (метиловый спирт) сильно токсичен, при работе о ним требуется особая осторожность.
Химическая формула метилового спирта СН80Н, молекулярная масса 32,04. Метиловый спирт называют также метановым, древесным спиртом, карбинолом. Метанол представляет собой бесцветную жвдкость, иногда с резким запахом (в зависимости от слоооба получения и очистки). Давление паров метанола при 20°С равно 89мм рт.ст., температура замерзания - 97,1°С, кипения +64,65°С. Некоторые физические характеристики метанола при нормальных усло
Вязкость, сП..................0,817
Диэлектрическая проницаемость.........32,63
Температура вспышки, °С ............ 8
Температура самэвоспламенения, °С.......464
Гремели взрываемости паров с воздухом,
нижний................6,0
верхний................34,8
Критическое давление, кгс/см2.........78,7
Критическая температура, С. . . ........240,0
Литическая плотность, г/см8..........0,272
Критический объем, см3/моль .......... 118
о
Вязкость в критической точке, сП....... 1,695*10
Термохимические характеристики метанола (ккал/моль) приведены ниже:
а) теплота сгорания:
173,65
газообразного .............. 177,40
б) теллота парообразования при:
0°С.....................9,192
25°С................... 8,94
64,7°С................... 8,42
230°С................... 2,816
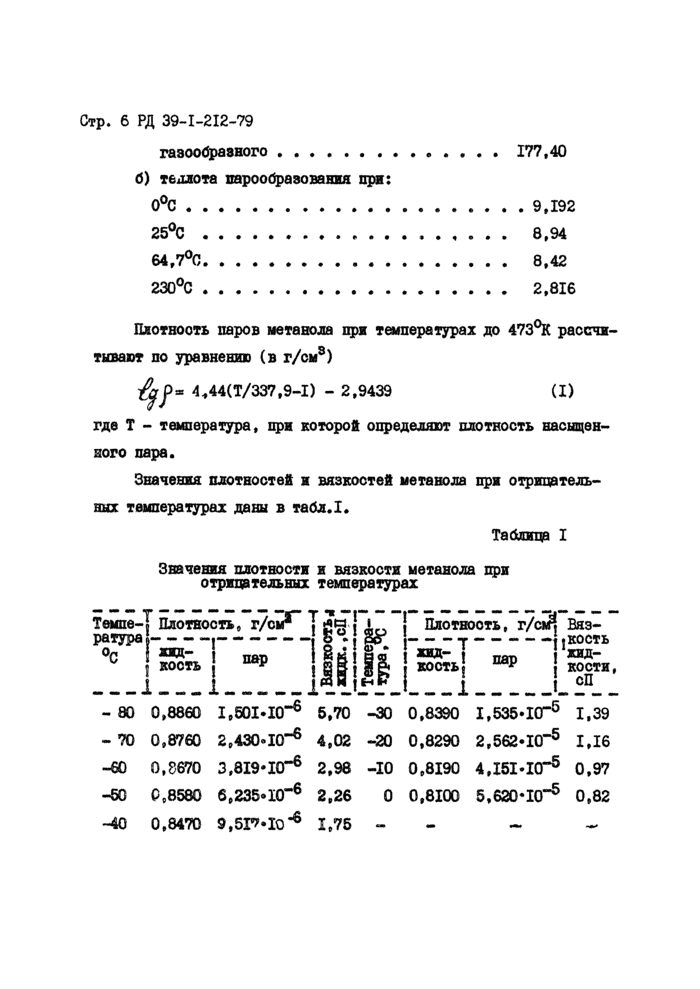
Шютнооть паров метанола при температурах до 473°К рассчитывают по уравнению (в г/см8)
где Т - температура, при которой определяют плотность насыщенного пара.
Значения плотностей и вязкостей метанола при отрицательных температурах даны в табл.1.
Значения плотности и вязкости метанола при отрицательных температурах
Темпе-]* Плотность, г/с?" J
К
! Плотнооть, т/ad Вяз-
----г-----..кость
*яд- 1 жвд-
I КОСТЬ “Р ! кости, i СП
- 80 0,8860 1,501*10“® 5.70 -30 0,8390 1,535*10“® 1,39
- 70 0,8760 2,430*10“® 4.02 -20 0,8290 2,562*10“® 1,16
-60 0,8670 3,819*10“® 2,98 -10 0,8190 4.I5I.I0-5 0,97
-50 0,8580 6,235*10“® 2,26 0 0,8100 5,620*10“® 0,82
-40 0,8470 Э.бГМО-6 1,75 - -
В тайл.2 приведены некоторые свойотва, которыми должен обладать поступающий на промыслы метанол по ГОСТУ 2222-70.
Таблица 2
Некоторые свойства метанола
|
Покаиатели |
I Синтети- !
1 чес кий j-
i____I. |
Лесохимический I сорт | П сорт |
|
Внешний туид
20
Плотность , г/смэ |
Бесцветная прозрачная жидкость без механических примесей |
|
0,791-0,793 |
0,793 |
0.793 |
|
Пределы кипения, °С при 7ъ0 мм рт.ст.: |
|
начало кипения, не ниже |
64,0 |
64,0 |
63,5 |
|
конец кипения, не выше |
65,0 |
66,0 |
66,0 |
|
В этих пределах должно отгоняться, не менее, % об. |
99,0 |
98,0 |
97,0 |
|
Кислотное число в мг КОН не I г СНдОН, не более |
0,03 |
0,02 |
0,04 |
|
Эфирное число в мг КОН на I г СНдОН |
0,08 |
0,2 |
0.4 |
|
Содержание серы, не более,% |
0,002 |
Не нормируется |
|
Содержание железа,не более,% |
0,001 |
То же |
|
Большой практический интерес при промысловой обработке rasa представляет система метанол - вода. Это неидеальный раствор, свойства которого трудно найти исходя из сэоигтв чисты компонентов.
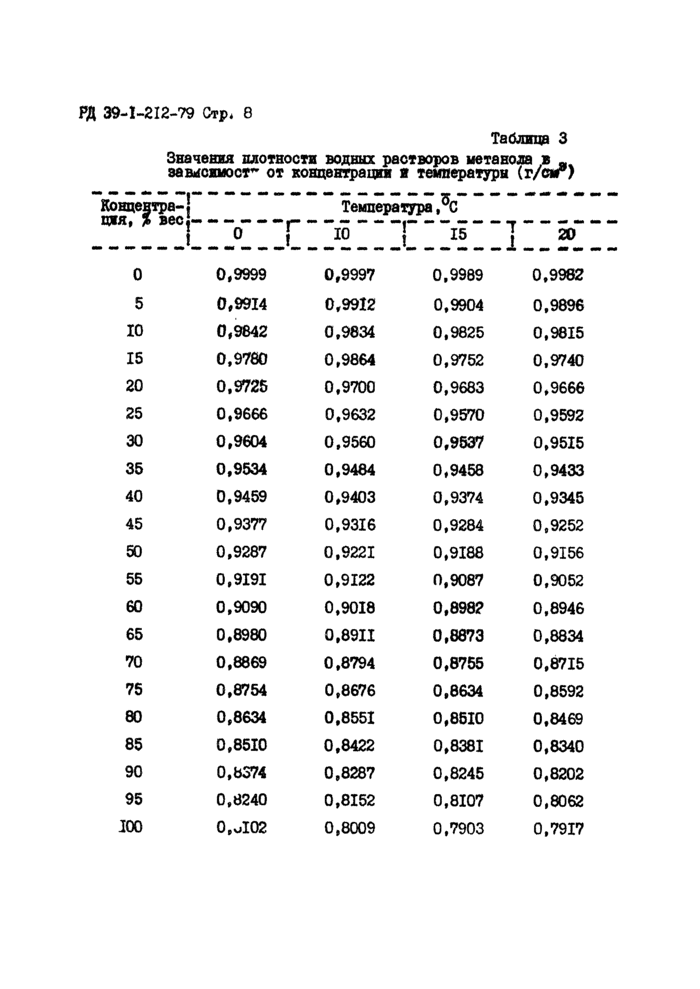
Изменение плотностей водных растворов метанола в зависимости от концентрации метанола в растворе представлено в табл.З.
Таблица 3
Значения плотности водных растворов ыетанода в _ ваысжмост- от концентрации я температуры (г/см*)
|
20 |
|
0 |
0,9999 |
0,9997 |
0,9989 |
0,9982 |
|
5 |
0,9914 |
0,9912 |
0,9904 |
0,9896 |
|
10 |
0,9842 |
0,9834 |
0,9825 |
0,9815 |
|
15 |
0,9780 |
0,9864 |
0,9752 |
0,9740 |
|
20 |
0,9725 |
0,9700 |
0,9683 |
0,9666 |
|
25 |
0,9666 |
0,9632 |
0,9570 |
0,9592 |
|
30 |
0,9604 |
0,9560 |
0,9537 |
0,9515 |
|
35 |
0,9534 |
0,9484 |
0,9458 |
0,9433 |
|
40 |
0,9459 |
0,9403 |
0,9374 |
0,9345 |
|
45 |
0,9377 |
0,9316 |
0,9284 |
0,9252 |
|
50 |
0,9287 |
0,9221 |
0,9188 |
0,9156 |
|
55 |
0,9191 |
0,9122 |
0,9087 |
0,9052 |
|
60 |
0,9090 |
0,9018 |
0,898? |
0,8946 |
|
65 |
0,8980 |
0,8911 |
0,8873 |
0,8834 |
|
70 |
0,8869 |
0,8794 |
0,8755 |
0,8715 |
|
75 |
0,8754 |
0,8676 |
0,8634 |
0,8592 |
|
80 |
0,8634 |
0,8551 |
0,8510 |
0,8469 |
|
85 |
0,8510 |
0,8422 |
0,8381 |
0,8340 |
|
90 |
0,Ь374 |
0,8287 |
0,8245 |
0,8202 |
|
95 |
0,8240 |
0,8152 |
0,8107 |
0,8062 |
|
100 |
0.Л02 |
0,8009 |
0,7903 |
0,7917 |
|
При увеличении содержания воды в метаноле температура замерзания растворов понижается и при содержании метанола в смеси 93,3$ составляет - 137°С (эвтектическая точка табл.4)»
Вязкость системы метанол - вода всегда больше вязкости чистого метанола и в исследованном интервале температур (от -10 до +60°С) имеет максимум при содержании 30-40$ метанола в смеси (табл.5).
Таблила 4
Значения температуры затвердевания водометанольных растворов
Концент- ! Температура затвер-Тконцент-! Температура эатвер-радия ме-'^^девания^ _С____рация ме-_ девания. «С____
l^ec!' 5 начал0 I конец { начало j конец
начало
-7,5
-18,5
-31,5
-40,7
-72,5
-87,0
-8,0
-20,3
-35,0
-54,0
-96,0
-116,0
-102,5 -115,0 -128,0 -121,8 -109,0 - 97,8
-132,0 -137,0 -137,0 -132,0 -113,0 - 97,8
Темпе-J____Ко нце н тр а щч_метанола в смеси, $_вес. __ <
P8<pafl0 ~|_20 1 30 J 40 j 50 j~60 [ 70~ ] 80 \ X
|
Таблица 5
Значения вязкости водных растворов метанола (сП) |
|
-10 |
4,58 |
5,70 |
6,15 |
6.12 |
3,33 |
4,30 |
3,20 |
2,20 |
1,63 |
1,15 |
|
0 |
2,60 |
3,17 |
3,40 |
3,46 |
3,18 |
2,63 |
2.Ю |
1,73 |
2.31 |
0,90 |
|
20 |
1,35 |
1,60 |
1,78 |
1,80 |
^75 |
1,63 |
1,43 |
1,15 |
0,89 |
0,60 |
|
30 |
1,02 |
1,20 |
1,32 |
1,35 |
1,33 |
1,25 |
1,13 |
0,93 |
0,72 |
0,50 |
|
40 |
0,80 |
0,93 |
1,02 |
1,07 |
1,05 |
1,00 |
0,90 |
0,75 |
0.60 |
0,45 |
|
60 |
0,55 |
0,60 |
0,65 |
0,68 |
0,66 |
0,65 |
0,60 |
0,52 |
0,48 |
0,35 |
|