МИНИСТЕРСТВО ПРИРОДНЫХ РЕСУРСОВ
И ЭКОЛОГИИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральная служба по гидрометеорологии
и мониторингу окружающей среды (Росгидромет)
|
РЕКОМЕНДАЦИИ
|
Р 52.24.741-2010
|
ОЦЕНКА ТОКСИЧНОСТИ ПОВЕРХНОСТНЫХ ВОД СУШИ
В УСЛОВИЯХ ЧРЕЗВЫЧАЙНЫХ СИТУАЦИЙ
МЕТОДОМ ЭКСПРЕССНОГО БИОТЕСТИРОВАНИЯ
Ростов-на-Дону
2010
Предисловие
1 РАЗРАБОТАНЫ Государственным учреждением Гидрохимический
институт (ГУ ГХИ)
2 РАЗРАБОТЧИКИ Е.Н. Бакаева, д-р биол. наук, Н.А. Игнатова, канд. биол. наук
3
СОГЛАСОВАНЫ с ГУ «НПО «Тайфун» 04.10.2010
И УМЗА Росгидромета
11.10.2010
4 УТВЕРЖДЕНЫ Заместителем Руководителя Росгидромета 12.10.2010
5 ЗАРЕГИСТРИРОВАНЫ ЦМТР ГУ «НПО «Тайфун» за номером
Р 52.24.741-2010 от 19.10.2010
6 ВВЕДЕНЫ ВПЕРВЫЕ
Введение
Метод биотестирования широко используется в последнее время
для оценки токсичности и поверхностных вод, и донных отложений. Информация, получаемая в ходе биотестирования дает информацию о
воздействии на гидробиоту всего комплекса находящихся в водном объекте веществ. В случаях экстремально высоких загрязнений и в условиях чрезвычайных ситуаций (ЧС) необходимо получение оперативной информации для принятия управленческих решений. В связи с чем необходимо использовать экспрессные методики биотестирования.
Настоящие рекомендации отвечают требованиям оперативности получения биологической информации: 1)
реакция хемотаксиса позволяет практически за 1 ч получить ответную реакцию тест-объектов на воздействие исследуемой пробы воды; 2)
выбранный тест-объект (Paramecium caudatum) является одним из центральных видов микрозоопланктеров практически во всех водных объектах, что позволяет использовать его во всех регионах страны; 3)
методика биотестирования по выживаемости зоопланктеров позволяет использовать природные
популяции исследуемого региона, отобранные в фоновых (незагрязненных участках) водных объектов. В связи с тем, что гидробионты реагируют на специфику гидрохимического состава водных объектов различных регионов предпочтительнее использовать в случаях ЧС природные
популяции гидробионтов, отобранные из фоновых (условно чистых участков). Для этого в рекомендациях приведен список возможных тест-объектов с указанием их экологических особенностей в отношении температурного фактора, рН-среды, минерализации.
ОЦЕНКА ТОКСИЧНОСТИ ПОВЕРХНОСТНЫХ ВОД СУШИ
В УСЛОВИЯХ ЧРЕЗВЫЧАЙНЫХ СИТУАЦИЙ
МЕТОДОМ ЭКСПРЕССНОГО БИОТЕСТИРОВАНИЯ
Дата введения - 2011-10-01
1
Область применения
Настоящие рекомендации устанавливают методику экспрессного
биотестирования и порядок проведения оценки токсичности поверхностных вод суши (ПВС) в условиях чрезвычайных ситуаций (ЧС) и проведения оперативных работ в мониторинге ПВС в условиях ЧС.
Рекомендации предназначены для организаций наблюдательной
сети Федеральной службы по гидрометеорологии и мониторингу окружающей среды (Росгидромета), осуществляющих организацию и проведение наблюдений за загрязнением ПВС в составе Государственной
службы наблюдений за состоянием окружающей среды (ГСН) России.
Настоящие рекомендации могут быть использованы в качестве методического пособия специалистами и практическими работниками природоохранных организаций, осуществляющих наблюдения за загрязнением окружающей среды, а также для оценки токсического загрязнения
поверхностных вод суши.
2 Нормативные ссылки
В настоящих рекомендациях использованы ссылки на следующие нормативные документы:
ГОСТ 19179-73 Гидрология суши. Термины и определения
ГОСТ
17.1.1.01-77 Охрана природы. Гидросфера. Использование и охрана вод. Основные термины и определения
ГОСТ
17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных
осадков
ГОСТ 27065-86 Качество вод. Термины и определения
Р 52.24.566-94 Рекомендации. Методы токсикологической оценки
загрязнения пресноводных экосистем
РД 52.24.609-99 Организация и проведение наблюдений за содержанием загрязняющих веществ в донных отложениях
РД 52.24.635-2002 Проведение наблюдений за токсическим загрязнением донных отложений в пресноводных экосистемах на основе биотестирования
РД
52.24.309-2004 Организация и проведение режимных наблюдений за загрязнением поверхностных вод суши на сети Росгидромета
РД 52.24.662-2004 Рекомендации. Оценка токсического загрязнения
природных вод и донных отложений пресноводных экосистем методами биотестирования с использованием коловраток
РД
52.24.670-2005 Унифицированный метод определения острой
токсичности проб поверхностных вод суши, содержащих взвешенные
вещества
Р 52.24.690-2006 Рекомендации. Оценка токсического загрязнения
вод водотоков и водоемов различной солености и зон смешения речных и морских вод методами биотестирования
Р 52.24.695-2007 Рекомендации. Оценка токсического загрязнения
природных вод и донных отложений водных экосистем по коэффициенту регенерации популяции
Примечание - Ссылки на остальные нормативные документы приведены в разделе 6, пунктах 7.2 и 8.2.
3 Термины, определения и обозначения
В настоящих рекомендациях использованы следующие термины и
определения:
3.1
биотестирование (биологическое тестирование): Оценка качества объектов окружающей среды (воды и др.) по ответным реакциям живых организмов, являющихся тест-объектами
[ГОСТ 27065-86, статья 39]
3.2 биотест: Совокупность приемов получения информации о токсичности воды (донных отложений) для гидробионтов на основе регистрации реакций тест-объекта (Р
52.24.566).
3.3 водный объект: Сосредоточение природных вод на поверхности суши, либо в горных породах имеющее характерные формы распространения и черты режима (Р
52.24.566).
3.4 загрязнение токсическое: Загрязнение воды водоемов и водотоков токсичными веществами.
3.5 зоопланктеры: Представители зоопланктона (совокупность населяющих толщу воды беспозвоночных животных, пассивно переносимых течениями) [1].
3.6
качество воды: Характеристика состава и свойств воды, определяющая пригодность ее для конкретных видов водопользования
[ГОСТ 27065-86, статья 2]
3.7
контроль качества воды: Проверка соответствия показателей
качества воды установленным нормам и требованиям
[ГОСТ 27065-86, статья 2]
3.8 критерий токсичности: Значение показателя токсичности, на
основании которого судят о наличии токсического действия.
3.9 метрологическая характеристика метода: Характеристика
чувствительности метода, определяемая для тест-объекта по LC50 при
воздействии эталонного токсиканта (медь (II) сернокислая, калий двухромовокислый).
3.10 острое токсическое действие (острая токсичность); ОТД: Воздействие, вызывающее быструю ответную реакцию тест-объекта. Острое токсическое действие чаще всего определяют по тест-реакции «гибель» или «выживаемость» в условиях кратковременного
биотестирования. При использовании коловраток и других организмов
микрозоопланктона длительность воздействия составляет от 6 до 24 ч (РД
52.24.662).
3.11 показатель токсичности: Признак тест-объекта, используемый для оценки токсичности воды.
3.12 поверхностные воды суши; ПВС: Воды, находящиеся на поверхности суши в виде различных водных объектов (Р
52.24.566).
3.13 проба воды: Количество воды, предназначенное для исследования.
3.14 пункт наблюдений за загрязнением поверхностных вод
суши Государственной сети наблюдений Росгидромета: Место на
водоеме или водотоке, где проводят комплекс работ для получения данных о качестве воды или донных отложений. (РД
52.24.635).
3.15 результат биотестирования: Конечный вывод о токсичности
водной среды, установленный в ходе биотестирования.
3.16 тест-объект: Организм, который используют при биотестировании (инфузории, дафнии и т.д.) (Р
52.24.566).
3.17 тест-показатель: Показатель жизнедеятельности (поведенческие реакции, размножение, выживаемость и т.д.) тест-объекта, используемый для определения токсичности ПВС.
3.18 токсичность воды: Свойство воды вызывать патологические
изменения или гибель организмов, обусловленные присутствием в ней
токсичных веществ (Р 52.24.566).
3.19 токсикологический эксперимент: Эксперимент, в ходе которого оценивают влияние на тест-объект испытываемой воды или химического соединения. Состоит из двух серий: опыт (с воздействием воды или химического соединения) и контроль (без воздействия, но в
тех же условиях) (Р 52.24.566).
3.20 условно чистый участок водного объекта: Обычно это фоновый створ.
3.21 фоновый створ: Створ, расположенный на расстоянии не
менее 1 км выше источника загрязнения (Р 52.24.566).
3.22 хемотаксис: Двигательные реакции свободно передвигающихся растительных и простейших животных организмов, а также клеток
(зооспор, сперматозоидов, лейкоцитов и др.) под влиянием химических
раздражителей [2].
3.23 чрезвычайная ситуация; ЧС: Обстановка на определенной
территории, сложившаяся в результате аварии, опасного природного явления, катастрофы, стихийного или иного бедствия, которые могут повлечь или повлекли за собой человеческие жертвы, ущерб здоровью
людей или окружающей природной среде, значительные материальные потери и нарушение условий жизнедеятельности людей [3].
3.24 чувствительность тест-объекта: Нижняя граница диапазона
действия эталонного токсиканта, при которой обнаруживают параметры его токсичности на тест-объект.
3.25 эталонный токсикант: Токсическое вещество, используемое
для проверки чувствительности биотеста или тест-объекта (Р
52.24.566).
3.26 LC50: Концентрация токсиканта, приводящая к гибели 50
% взятой для эксперимента выборки.
4 Общие положения
4.1 Настоящие рекомендации устанавливают требования и условия по проведению экспрессного биотестирования ПВС в условиях ЧС, обусловленного высоким уровнем загрязнения или присутствием опасных токсических веществ, поступающих в водные объекты в ходе аварий, залповых сбросов, с целью выяснения чрезвычайных экологических ситуаций.
4.2 Экспрессное биотестирование ПВС проводят с целью проверки соответствия качества отдельных исследуемых проб воды установленным нормам без идентификации загрязняющих веществ и их количественных характеристик [4].
4.3 Вода контрольного створа (природная вода) не должна оказывать токсического действия (хронического и, тем более, острого) на тест-объекты, используемые для биотестирования [4].
4.4 Биотестирование ПВС основано на определении показателей
токсичности исследуемой пробы воды, отобранной в зоне влияния источника загрязнения, и их отличий от контрольной пробы, отобранной на условно чистом участке водного объекта и водопроводной водой исследуемого региона.
4.5 Экспрессное биотестирование токсичности ПВС в условиях ЧС
дает возможность за короткий промежуток времени:
- оценить токсичность пробы воды;
- выявить точки (створы) и участки с чрезвычайной экологической ситуацией;
- оценить влияние источников загрязнения на состояние водной составляющей водного объекта;
- оценить экотоксикологический статус водного объекта или его участка;
- оценить эколого-токсикологическое состояние водного объекта в
комплексе с методами биоиндикационных и физико-химических исследований.
4.6 Для оценки токсичности ПВС используют не менее трех биотестов с разными тест-объектами, либо трех тест-показателей одного тест-объекта. Набор биотестов и тест-показателей должен экологически соответствовать региону исследования согласно приложениям А, Б и (Р 52.24.690).
4.7 В составе системы мониторинга ПВС режимные наблюдения и наблюдения в условиях ЧС по токсикологическим показателям методом
биотестирования проводят по программам работ оперативно-производственных подразделений территориальных управлений по гидрометерологии и мониторингу окружающей среды (УГМС) Росгидромета
в соответствии с требованиями РД
52.24.309 - для поверхностных вод суши, РД
52.24.609 и РД 52.24.635 - для вод и донных отложений.
4.8 Результаты по оценке токсичности вод методом биотестирования в условиях ЧС, в зависимости от их масштаба, представляют в органы управления Единой государственной системы предупреждения и ликвидации ЧС (РСЧС) соответствующего уровня (региональный, территориальный и местный, объектовый).
5 Основные принципы биотестирования поверхностных вод суши в условиях ЧС
5.1 В ходе биотестирования ПВС в условиях ЧС устанавливают:
- наличие либо отсутствие токсического действия отдельных проб воды;
- острое токсическое действие отдельных проб воды;
- кратность разбавления вод., снимающую ОТД, в случае его обнаружения;
- район экологического неблагополучия исследуемой акватории.
5.2 Экспрессное биотестирование ПВС проводят с использованием
различных тест-объектов: инфузорий, коловраток, ракообразных, микроводорослей, макрофитов, а также природных популяций гидробионтов, отобранных из условно чистых (фоновых) участков исследуемого водного объекта.
5.3 Использование природных популяций гидробионтов имеет преимущества:
- гидробионты из исследуемого водного объекта исключают реакцию на физико-химические особенности воды, которая может иметь место у лабораторных культур гидробионтов;
- возможность прогнозирования состояния конкретных популяций
гидробионтов в исследуемом регионе в связи с произошедшим загрязнением.
Использование природных популяций гидробионтов имеет недостатки:
- адаптация к слабому постоянному воздействию загрязнения на фоновом участке, если оно имеет идентичную природу с воздействием на загрязненном участке;
- заранее нельзя предвидеть, какие именно организмы можно будет выделить на фоновом участке исследуемого водного объекта.
5.4 Оптимальным является проведение одновременного биотестирования на природных популяциях гидробионтов и лабораторных культурах тест-объектов с известными характеристиками и известной чувствительностью к загрязняющим веществам (проверка пригодности культуры к биотестированию по эталонному токсиканту).
5.5 Наиболее важным показателем, на основе которого можно дать прогноз развития популяции, является размножение. Время получения результатов по показателю размножения на общепринятом тест-объекте Daphnia magna составляет 30 сут. В условиях ЧС информация
должна быть оперативной, поэтому преимущество среди тест-объектов нужно отдать короткоцикличным тест-объектам: инфузориям, коловраткам, микроводорослям.
5.6 Экспрессное биотестирование ПВС проводят:
а) с использованием экспрессных тест-показателей:
- скорость потребления пищи организмами-фильтраторами инфузориями, коловратками в соответствии с РД
52.24.662 (раздел 10) и
РД
52.24.670;
- скорость фотосинтеза растительных тест-объектов, A-Z-Ph-тест на микроводорослях в соответствии с Р
52.24.566;
- поведенческие реакции - хемотаксис в соответствии с приложением В.
б) с использованием тест-показателей:
- выживаемость или гибель на тест-объектах, экологически соответствующих исследуемому водному объекту; выживаемость на тест-объектах из представителей крупного рачкового планктона можно наблюдать визуально без микроскопирования в соответствии с РД
52.24.662, Р 52.24.690, Р 52.24.695;
- размножение, позволяющее при использовании короткоцикличных тест-объектов (микроводоросли, инфузории, коловратки) в короткие
сроки определить не только их выживаемость, но и размножение, и показывающее возможность сохранения популяции в соответствии с РД
52.24.662, Р 52.24.690, Р 52.24.695;
- комплекс показателей (выживаемость и размножение) в сопряженности со временем
(24, 48, 72 ч), позволяющее при использовании короткоцикличных гидробионтов (инфузории, коловратки) дать прогноз
развития популяции в соответствии с Р 52.24.566, РД
52.24.662.
5.7 Длительность биотестирования (продолжительность экспозиции) зависит от жизненного цикла выбранного тест-объекта. Микроводоросли за сутки дают до 8 поколений, инфузории - до 4 - 6, коловратки - до 3.
5.8 В ходе биотестирования используют два контроля: дехлорированную водопроводную воду региона и воду из условно чистого (фонового) участка исследуемого водного объекта.
5.9 Каждый биотест проводят не менее чем в трех повторностях.
5.10 Оценку токсичности ПВС проводят по набору биотестов (не менее трех). Например, с тест-объектами парамеции, коловратки, дафнии. Либо по двум тест-объектам (парамеции, дафнии) и нескольким тест-показателям одного из тест-объектов (хемотаксис и гибель парамеций).
5.11 Обязательным в условиях ЧС при обнаружении ОТД вод является определение кратности разбавления исследуемой пробы воды, снимающей токсическое воздействие. Кратность разбавления -
2; 10; 25; 50; 100 и 500 раз. Разбавление проводят водой, отобранной из фонового створа, или отстоянной дехлорированной водопроводной водой
исследуемого региона.
5.12 Требования к порядку проведения и оценке результатов биотестирования проводят согласно РД
52.24.669.
6 Отбор, хранение и подготовка проб поверхностных вод суши для биотестирования
6.1 Пробы ПВС для биотестирования отбирают с учетом требований ГОСТ
17.1.5.05 и Р 52.24.566.
6.2 Объем пробы не менее 0,05 дм3 (при использовании в биотестировании тест-объектов из числа микрозоопланктона) и не менее 1,5
дм3 (при использовании микроводорослей и рачкового планктона).
6.3 Сосуды должны быть из материала, не содержащего токсичных примесей (полиэтиленовые емкости для пищевых продуктов, стеклянные баллоны и бутыли).
6.4 Сосуды необходимо маркировать.
6.5 Перед заполнением сосудов воду фильтруют через мельничный газ № 70-76 (для удаления природного планктона) и несколько раз ополаскивают сосуд. Заполняют водой полностью.
6.6 Анализ проб воды по определению токсичности проводят не позднее 6 ч после отбора проб.
6.7 В случае невозможности проведения исследований не позднее
6 ч после отбора пробы охлаждают до 4 °С или замораживают согласно РД
52.24.309 и хранят до 30 сут.
6.8 Консервирование проб химическими веществами не допускается.
6.9 Перед биотестированием измеряют концентрацию кислорода, значения рН (с целью дифференцирования токсического воздействия
каких-либо загрязняющих веществ и измеренных значений рН и кислорода, если эти параметры не обеспечивают нормальной жизнедеятельности гидробионтов).
6.10 Пробу делят на две части для проведения биотеста на фильтрованной (пропущенной через бумажный фильтр для удаления взвешенных веществ) и нефильтрованной воде.
7
Биотест по реакции хемотаксиса парамеций
7.1 Принцип метода
Биотест по реакции хемотаксиса основан на способности зоопланктеров, в частности парамеций, перемещаться в направлении или от источника химического воздействия. Хемотаксис положителен, если движение парамеций направлено к источнику химического раздражителя
(по градиенту его концентрации воде), и отрицателен, если движение направлено от источника. Влияние исследуемой воды оценивают по количеству переместившихся особей.
ОТД исследуемой воды на парамеций устанавливают за время экспозиции 2 часа.
Показателем реакции хемотаксиса служит среднее количество парамеций, переместившихся в исследуемую воду.
Критерием ОТД является положительный хемотаксис, когда средний процент исходного количества тест-объектов, переместившихся в
исследуемую воду, составляет не более 25 %.
7.2 Необходимые материалы, оборудование, реактивы
7.2.1 Культура парамеций Paramecium caudatum. Описание основных характеристик вида, источники получения культуры и условий культивирования даны в приложениях Г и Д.
7.2.2 Микроскоп бинокулярный стереоскопический марки МБС по ГОСТ
8074-82.
7.2.3 Дрожжи пекарские сухие.
7.2.4 Пипетки выдувные капиллярные (пастеровские, укороченные с двух сторон или глазные с оттянутым носиком) по ГОСТ
29230-91.
7.2.5 Чашки Петри по ГОСТ
25336-82.
7.2.6 Фильтровальная бумага синяя лента.
7.2.7 Стаканы вместимостью 0,5 - 1,0 дм3 по ГОСТ
23932-90.
7.2.8 Вода дехлорированная водопроводная исследуемого региона.
7.3 Подготовка
к биотестированию
Исходный материал для биотестирования получают за 1 -
3 сут до опыта. Для этого парамеций пересаживают в чистые чашки Петри с дехлорированной водопроводной водой, в которую предварительно вносят
корм (один - два кусочка сухих пекарских дрожжей размером 1 мм3 на одну чашку Петри).
Биотестирование проводят при комнатной температуре без смены
воды в нестерильных условиях, в защищенном от прямого солнечного света месте.
7.4 Проведение
биотестирования
Общий объем воды для биотестирования одной пробы воды 50 см3.
Для проведения токсикологического эксперимента в чашку Петри
вносят каплю (0,1 см3) культуральной среды с парамециями. Под микроскопом марки МБС подсчитывают исходное количество парамеций. Далее в эту же чашку Петри рядом с первой каплей вносят каплю исследуемой воды. С помощью пипетки делают перемычку из капли контрольной воды в исследуемую воду. Наблюдают за скоростью перехода
парамеций из исходной капли в опыт.
Используют два контроля: дехлорированную водопроводную воду
исследуемого региона и воду из фонового условно чистого участка исследуемого водного объекта.
Каждую пробу воды исследуют в трех повторностях с двумя контролями, т.е. необходимо 6 чашек Петри на одну исследуемую пробу. Постановку каждого варианта проводят через 5 мин, необходимых для учета исходного количества парамеций в контрольной капле под бинокулярной лупой.
7.5 Регистрация
реакции хемотаксиса
Регистрация реакции хемотаксиса основана на учете численности переместившихся парамеций в каждом варианте. Для оценки реакции
хемотаксиса учитывают количество особей, переместившихся из контрольной капли воды в исследуемую пробу воды.
Учет парамеций ведут под бинокулярной лупой (увеличение 4×12,4) через 15, 30, 60, 120 мин.
7.6 Обработка
результатов, расчеты и оценка токсичности воды
В таблицу Е.1 (приложение Е) заносят дату проведения биотестирования, номер пробы, номер повторности, количество парамеций, переместившихся в исследуемую воду (в каждой повторности).
Результаты биотестирования оценивают по положительному хемотаксису, т.е. количеству парамеций, переместившихся из контрольной
воды в исследуемую.
В каждом варианте токсикологического эксперимента рассчитывают
процент парамеций, переместившихся в исследуемую воду. Затем подсчитывают средний процент переместившихся особей на основании
результатов трех параллельных определений в контроле и в опыте.
Если количество переместившихся из контрольных вариантов
в исследуемую воду парамеций составляет не более 25 %, то воду оценивают как оказывающую ОТД.
Полученные результаты биотестирования заносят в таблицу Е.1 (приложение Е).
7.7 Метрологическая
характеристика метода
Диапазон перемещения парамеций из контрольной в исследуемую воду в случае положительного хемотаксиса составляет от 0 %
до 100 % с внутрилабораторной прецизионностью 25
%.
8 Биотест по выживаемости зоопланктеров
8.1 Принцип метода
Методика основана на оценке влияния исследуемой воды, отобранной из водных объектов, на зоопланктеров. Тест-объектами могут служить лабораторные культуры парамеций, коловраток, дафний, цериодафний, а также природные популяции этих зоопланктеров, отобранные
из фоновых (условно чистых) участков водного объекта. Природные популяции используют в экспедиционных условиях при ЧС. Принципы биотестирования на природных популяциях в основном те же, что и на лабораторных культурах.
В случае ЧС оценивают ОТД пробы воды по изменению показателя выживаемости тест-объектов при экспозиции в исследуемой воде. Показателем выживаемости служит среднее количество тест-объектов, выживших в исследуемой воде за время опыта.
Критерием ОТД является снижение выживаемости тест-объектов не менее чем на 50 % в исследуемой воде по сравнению с контролем. Выживаемость в контроле при этом должна быть не менее 90 %. Наблюдения за выживаемостью проводят через 15;
30; 60 мин, далее через каждый час. Продолжительность биотестирования 24 ч.
8.2 Необходимые материалы, оборудование, реактивы
8.2.1 Культура тест-объекта из представителей зоопланктеров (см. приложения А и Б).
8.2.2 Микроскоп бинокулярный стереоскопический марки МБС по ГОСТ
8074-82.
8.2.3 Пипетки выдувные капиллярные (пастеровские, укороченные с двух сторон или глазные с оттянутым носиком) по ГОСТ
29230-91.
8.2.4 Чашки Петри по ГОСТ
25336-82.
8.2.5 Стаканы вместимостью 0,5 - 1,0 дм3 по ГОСТ
23932-90.
8.2.6 Вода дехлорированная водопроводная исследуемого региона.
8.3 Проведение
биотестирования
При использовании в качестве тест-объектов парамеций, коловраток берут по капле массовых культур этих зоопланктеров и помещают в
чашку Петри. Фильтровальной бумагой отбирают излишки воды, добавляют 1 см3 исследуемой воды. Под микроскопом подсчитывают исходное количество парамеций. Через 15;
30; 60 и 120 мин подсчитывают количество выживших парамеций.
При использовании в качестве тест-объектов крупного рачкового
планктона (дафнии, цериодафнии, симоцефалюсы), их отсаживают по 10 экземпляров в стаканы вместимостью 0,5 - 1,0 дм3 и добавляют 0,5 дм3 исследуемой воды.
При использовании в качестве тест-объектов бокоплавов их отсаживают по 10 экземпляров в чашки Петри.
В качестве контроля используют воду фонового (условно чистого) участка, на котором отловлены используемые в качестве тест-объектов виды, и дехлорированную водопроводную воду исследуемого региона. В
контроле выживаемость должна быть не менее 90 %.
Все варианты опыта и контроля ставят не менее, чем в трех повторностях. Общее количество организмов в опыте должно быть не менее 30.
8.4 Регистрация
показателя выживаемости и оценка токсичности воды
В качестве тест-показателя токсичности используют выживаемость тест-объектов. Количество живых зоопланктеров регистрируют через 15;
30; 60; 120 мин и через 24 ч.
ОТД исследуемой воды на зоопланктеров устанавливают при кратковременном биотестировании (24
ч). Критерием токсичности служит процент от контроля выживших тест-объектов (при расчете по средним
значениям всех повторностей). В случае выживаемости не более 50 % тест-объектов от контроля исследуемую воду оценивают как оказывающую ОТД.
Выживаемость в контроле должна быть не менее 90 % от исходного количества зоопланктеров. В случае значения выживаемости тест-объектов в контроле ниже 90
% токсикологический эксперимент проводят на другой популяции тест-объектов.
Результаты заносят в таблицу Е.2 (приложение Е).
9 Определение
кратности разбавления воды, снимающего острое токсическое действие воды
9.1 Биотест при разбавлении воды, снимающей ОТД
В случае обнаружения ОТД необходимо выявить кратность разбавления исследуемой воды, которая снимает токсическое действие.
Кратность разбавления - 2; 10; 25; 50; 100; 500 раз. Разбавление
проводят водой, отобранной из фонового створа, или отстоянной дехлорированной водопроводной водой исследуемого региона.
Биотестирование проводят согласно разделам 7 и 8.
9.2 Оценка
токсичности воды на основе кратности разбавления пробы
В случае ЧС и при оперативных работах токсическое состояние оценивают на конкретный момент времени исследования. В этом случае при установлении ОТД воды находят кратность разбавления исследуемой воды, при которой токсичность не проявляется.
Оценку токсичности воды и экотоксикологического статуса водного
объекта или его участка с точки зрения благополучия водной экосистемы проводят согласно шкале таблицы 1.
Таблица 1 -
Шкала оценки токсичности и экотоксикологического статуса водного объекта или его участка [5]
|
Кратность
разбавления
|
Класс токсичности
|
Экотоксикологический статус
|
|
До 1:1 включ.
|
0 Нетоксичная
|
Чистая
|
|
Св. 1:1 до 1:25 включ.
|
1 Слабо токсичная
|
Олиготоксичная
|
|
" 1:25 " 1:50 "
|
2 Умеренно токсичная
|
Бета-мезотоксичная
|
|
" 1:50 " 1:100 "
|
3 Остро токсичная
|
Альфа-мезотоксичная
|
|
" 1:100 " 1:500 "
|
4 Весьма токсичная
|
Политоксичная
|
|
" 1:500
|
5 Чрезвычайно токсичная
|
Гипертоксичная
|
Результаты биотестирования заносят в таблицу Е.3 (приложение Е).
10 Оценка
токсичности воды методом биотестирования с использованием набора биотестов
10.1 Оценку токсичности исследуемой воды проводят по набору биотестов (см. 5.10). Использование набора биотестов с разными по
чувствительности тест-объектами и тест-показателями увеличивает вероятность обнаружения токсичности исследуемой воды.
10.2 Итоговая оценка токсичности ПВС является экспертной. Окончательную оценку проводят по тест-объекту и тест-показателю, проявившему наибольшую чувствительность к воздействию исследуемой
воды.
10.3 Токсичность воды оценивается словесно: «оказывает» или «не оказывает острое токсическое действие».
11 Требования
безопасности, охраны окружающей среды
11.1
При выполнении работ следует соблюдать общие требования к безопасности на водных объектах и в химических лабораториях, установленные в национальных стандартах и соответствующих нормативных документах.
11.2
Особых требований по экологической безопасности не предъявляется.
12 Требования
к квалификации оператора
К выполнению экспериментальных работ по оценке токсичности
ПВС методом экспрессного биотестирования допускаются лица, имеющие биологическое, экологическое образование, знакомые с основами
водной токсикологии, методами полевых и лабораторных гидробиологических исследований.
Приложение.
А
(рекомендуемое)
Экологические
характеристики гидробионтов, используемых в качестве тест-объектов при
биотестировании
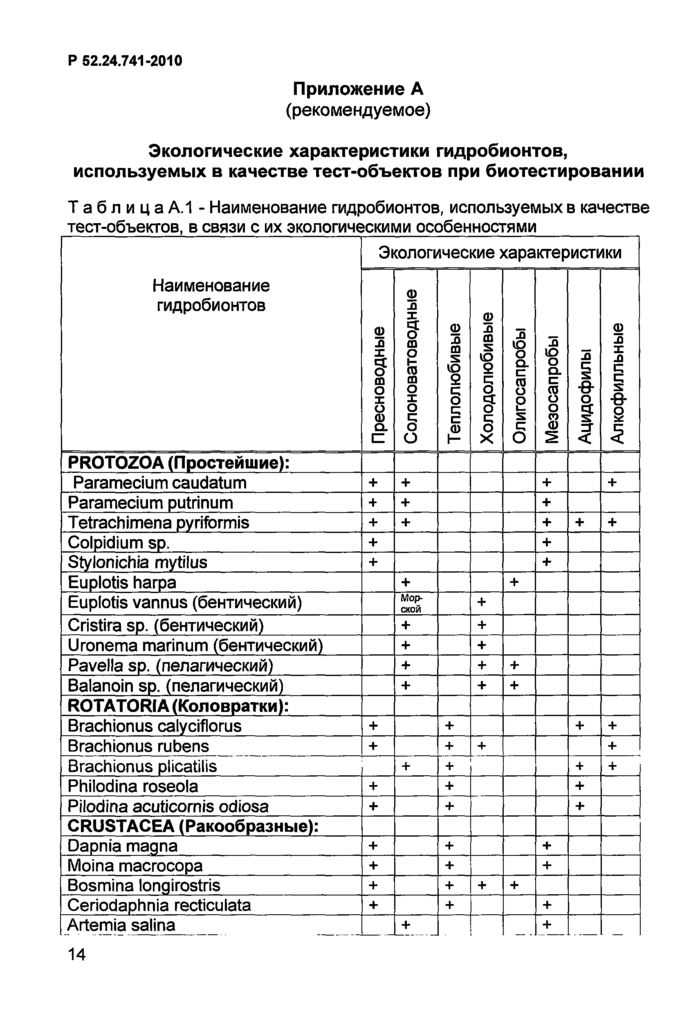
Таблица А.1 -
Наименование гидробионтов, используемых в качестве тест-объектов, в связи с их экологическими особенностями
|
Наименование
гидробионтов
|
Экологические характеристики
|
|
Пресноводные
|
Солоноватоводные
|
Теплолюбивые
|
Холодолюбивые
|
Олигосапробы
|
Мезосапробы
|
Ацидофилы
|
Алкофильные
|
|
PROTOZOA (Простейшие):
|
|
Paramecium
caudatum
|
+
|
+
|
|
|
|
+
|
|
+
|
|
Paramecium
putrinum
|
+
|
+
|
|
|
|
+
|
|
|
|
Tetrachimena pyriformis
|
+
|
+
|
|
|
|
+
|
+
|
+
|
|
Colpidium
sp.
|
+
|
|
|
|
|
+
|
|
|
|
Stylonichia mytilus
|
+
|
|
|
|
|
+
|
|
|
|
Euplotis harpa
|
|
+
|
|
|
+
|
|
|
|
|
Euplotis
vannus (бентический)
|
|
Морской
|
|
+
|
|
|
|
|
|
Cristira
sp. (бентический)
|
|
+
|
|
+
|
|
|
|
|
|
Uronema
marinum (бентический)
|
|
+
|
|
+
|
|
|
|
|
|
Pavella sp.
(пелагический)
|
|
+
|
|
+
|
+
|
|
|
|
|
Balanoin
sp. (пелагический)
|
|
+
|
|
+
|
+
|
|
|
|
|
ROTATORIA
(Коловратки):
|
|
Brachionus calyciflorus
|
+
|
|
+
|
|
|
|
+
|
+
|
|
Brachionus rubens
|
+
|
|
+
|
+
|
|
|
|
+
|
|
Brachionus plicatilis
|
|
+
|
+
|
|
|
|
+
|
+
|
|
Philodina roseola
|
+
|
|
+
|
|
|
|
+
|
|
|
Pilodina acuticornis odiosa
|
+
|
|
+
|
|
|
|
+
|
|
|
CRUSTACEA
(Ракообразные):
|
|
Dapnia magna
|
+
|
|
+
|
|
|
+
|
|
|
|
Moina macrocopa
|
+
|
|
+
|
|
|
+
|
|
|
|
Bosmina longirostris
|
+
|
|
+
|
+
|
+
|
|
|
|
|
Ceriodaphnia recticulata
|
+
|
|
+
|
|
|
+
|
|
|
|
Artemia salina
|
|
+
|
|
|
|
+
|
|
|
|
MOLLUSCA
(Моллюски):
|
|
Lymnaea stagnalis
|
+
|
|
+
|
|
|
|
|
|
|
Anadonta sp.
|
+
|
|
+
|
|
|
|
|
|
|
Dreissena sp.
|
+
|
+
|
+
|
+
|
|
|
|
|
|
Crassostrea
virginica устрицы
|
|
+
|
+
|
+
|
|
+
|
|
+
|
|
Ostrea irridescens устрицы
|
|
+
|
+
|
|
|
+
|
|
+
|
|
Mytilus gallopronvincialis мидии
|
|
+
|
+
|
|
|
+
|
|
+
|
|
Mytilus
edulis мидии
|
|
+
|
+
|
|
|
+
|
|
+
|
|
Mya
arenaria
|
|
+
|
+
|
|
|
+
|
|
+
|
|
Mytilaster sp.
|
|
+
|
+
|
|
|
+
|
|
+
|
|
Patella
vulgata
|
|
+
|
+
|
|
|
+
|
|
+
|
|
Rapana
tomassina
|
|
+
|
+
|
+
|
|
+
|
|
+
|
|
OLIGOCHAETA
(малощетинковые черви)
|
|
Aeolosoma hemprichi
|
+
|
|
+
|
|
|
|
+
|
|
|
INSECTA (Насекомые):
|
|
Chironomus
plumosus
|
+
|
|
+
|
+
|
|
|
|
+
|
|
Примечание - Знаком «+» обозначено наличие указанных
экологических особенностей гидробионтов.
|
Приложение
Б
(рекомендуемое)
Гидробионты,
используемые в качестве тест-объектов, и методы учета популяционных
характеристик
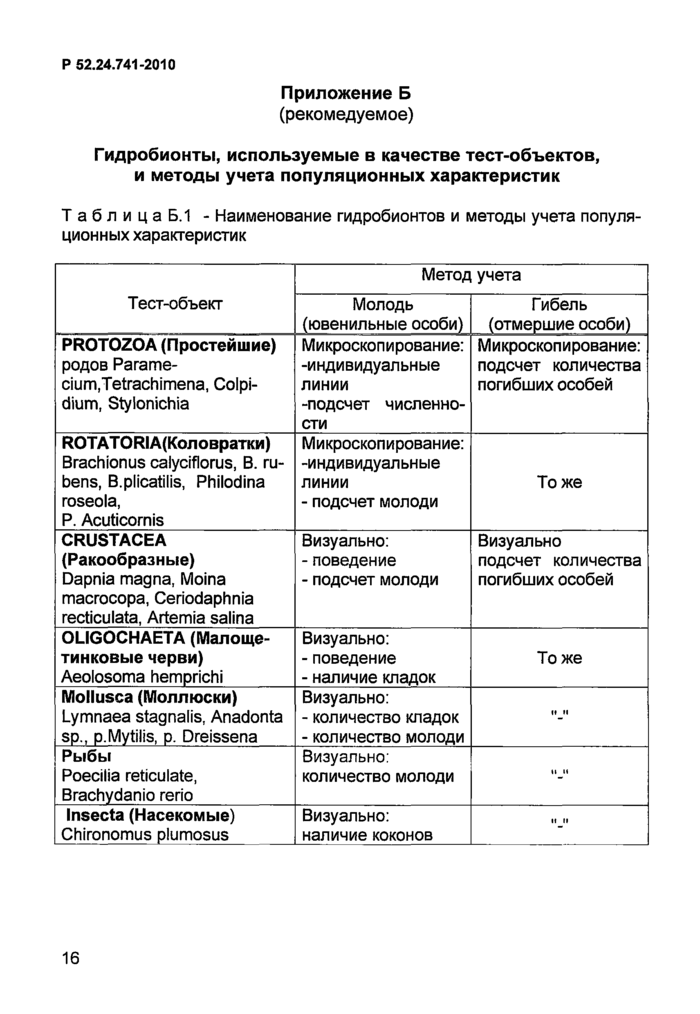
Таблица Б.1 -
Наименование гидробионтов и методы учета популяционных характеристик
|
Тест-объект
|
Метод учета
|
|
Молодь (ювенильные особи)
|
Гибель (отмершие особи)
|
|
PROTOZOA
(Простейшие)
родов
Paramecium, Tetrachimena, Colpidium, Stylonichia
|
Микроскопирование:
- индивидуальные
линии
- подсчет численности
|
Микроскопирование:
подсчет количества погибших особей
|
|
RОТАТОRIА (Коловратки)
Brachionus
calyciflorus, B. rubens, B. plicatilis, Philodina roseola, P. Acuticornis
|
Микроскопирование:
- индивидуальные
линии
- подсчет молоди
|
То же
|
|
CRUSTACEA
(Ракообразные)
Dapnia
magna, Moina macrocopa, Ceriodaphnia recticulata, Artemia salina
|
Визуально:
- поведение
- подсчет молоди
|
Визуально подсчет количества погибших особей
|
|
OLIGOCHAETA (Малощетинковые черви)
Aeolosoma
hemprichi
|
Визуально:
- поведение
- наличие кладок
|
То же
|
|
Mollusca (Моллюски)
Lymnaea
stagnalis, Anadonta sp., p. Mytilis, p. Dreissena
|
Визуально:
- количество кладок
- количество молоди
|
-"-
|
|
Рыбы
Poecilia
reticulate, Brachydanio rerio
|
Визуально:
количество молоди
|
-"-
|
|
Insecta (Насекомые)
Chironomus
plumosus
|
Визуально:
наличие коконов
|
-"-
|
Приложение
В
(справочное)
Хемотаксис
В.1
Хемочувствительность биоты возникла в истории жизни на Земле очень давно. С самого начала эволюции прокариоты были погружены в водную среду. Способность реагировать на химический состав среды была критичной для выживания. Хемотаксис - двигательные реакции свободно передвигающихся растительных и простейших животных организмов, а также клеток (зооспор, сперматозоидов, лейкоцитов и др.) под влиянием химических раздражителей. Хемотаксис может быть
положительным
- движение направлено к источнику химического раздражителя (по градиенту его концентрации в воздухе или воде), и отрицательным - движение направлено от источника. Явление хемотаксиса
известно
для ряда микроорганизмов и беспозвоночных животных.
В.2 Для возникновения хемотаксисов необходимо в среде создать градиент (неоднородность распределения) химического вещества, чтобы организм мог выбрать направление уменьшения вредного воздействия. Характеристиками таксиса служит концентрация организмов в исследуемой зоне через определенное время, которая измеряется оптическими приборами (бинокулярная лупа) (см. рисунок В.1)
Рисунок В.1 -
Реакция хемотаксиса на примере парамеций (туфелек) [2]
Приложение
Г
(справочное)
Характеристика
тест-объекта инфузории Paramecium caudatum
Г.1 Систематическое положение
Тип - Ciliophora, подтип - Ciliata, класс - Oligohymenophora, отряд - Hymenostomatida, подотряд - Peniculina, род - Paramecium, вид - Paramecium caudatum Ehrenberg, 1838 (в дальнейшем - парамеция).
Инфузории данного вида как тест-объект обладают рядом достоинств: высокая чувствительность к токсикантам, короткий жизненный
цикл, высокая скорость размножения, сочетание признаков эукариотной клетки и организма, ярко выраженные таксисы, достаточно широкая толерантность по отношению к температуре и солености, простота содержания в лабораторных условиях.
Г.2 Местообитание
P.caudatum - свободноживущая широко распространенная ресничная инфузория. Предпочитает альфа-мезосапробные условия, близкие к нейтральному значения рН =
6,5 - 7,5, температурный оптимум в пределах 24
- 28 °С. Обитает в пресных водоемах.
Г.3 Морфология, биология
Парамеции - наиболее сложно организованные простейшие, очень
чувствительные к изменению химического состава среды. Парамеции, представляющие собой одноклеточные организмы. Имеют сигарообразное или веретенообразно вытянутое в поперечном сечении округлое тело. Ресничный покров густой, равномерный. Сзади чуть удлиненный. Длина тела составляет 180
- 300 мкм [6]. Клетка парамеций содержит два
типа ядер: вегетативное и генеративное. Размножаются парамеции либо поперечным делением клеток (бесполое размножение), либо половым
путем, носящим характер коньюгации. Клетки делятся 1 - 2 раза в сутки.
Приложение
Д
(справочное)
Получение
исходного материала и содержание парамеций в лабораторных условиях
Д.1 Получение исходного материала для культуры парамеций
Получить исходный материал для культуры парамеций можно в институтах и учреждениях, занимающихся биотестированием с использованием парамеций (в том числе в ГХИ). Обычно этот вид встречается в
местных водоемах, поэтому можно самостоятельно вырастить культуру
парамеций.
Выделяют парамеций из природных вод методом концентрирования [7].
Для этого из водоема отбирают пробу воды объемом 5 л. Затем путем фильтрации ее через мембранный фильтр с размером пор 3 - 5 мкм получают концентрированную пробу объемом
0,04 дм3. Полученный концентрат пробы сливают в стакан. Затем осадок с фильтра смывают
полученным концентратом в чашки Петри. Высота слоя воды в чашке составляет 0,5 - 0,8 см. В чашки Петри добавляют корм - сухие пекарские
дрожжи (один - два кусочка размером 1 мм3). Полученные пробы оставляют на 1 - 3 сут. Часто уже через сутки начинается массовое развитие разных видов микрозоопланктона. В лаборатории специалист определяет нужный вид инфузорий (парамеций) под микроскопом. Заранее подготовленные чашки Петри наполняют дехлорированной водопроводной
водой и в них переносят парамеций с помощью капиллярной пипетки. Такую пипетку используют в дальнейшем при пересадке инфузорий. Начальная плотность размещения парамеций - 5 - 10 особей на одну чашку Петри. В течение 1 - 3 сут инфузорий адаптируют к лабораторным условиям и используют полученную культуру как исходную.
Д.2 Содержание культуры, кормление
Культуру инфузорий выращивают в климатостате, боксе или в любом помещении, не содержащих токсических паров или газов. Оптимальная температура для культивирования и биотестирования
22 ± 2 °С. Дополнительного освещения не требуется. Не допускается освещать парамеций прямыми солнечными лучами. Стеклянную посуду
для содержания инфузорий моют водопроводной водой, нельзя использовать для мытья синтетические моющие средства и органические растворители. В помещении, в котором находится культура парамеций, не
хранят летучие вещества и не работают с ними.
Для культивирования парамеций используют водопроводную дехлорированную воду или природную воду из незагрязненного водоема. Вода для культивирования должна удовлетворять следующим требованиям: рН =
6,5 - 7,5, жесткость общая 3 - 4 ммоль/л. концентрация растворенного кислорода не менее 6,0
мг/л.
Оптимальная плотность культуры 10 - 20 особей на 1 см3 воды. Один раз в 7 - 10 сут культуру пересевают. Чтобы обеспечить стандартные условия культивирования, поддерживающие культуру парамеций в стационарной фазе роста.
В качестве корма для парамеций используют сухие пекарских дрожжей. Для содержания парамеций в одной чашке Петри достаточно 1 - 2 кусочков сухих пекарских дрожжей размером 1 мм3.
Д.3 Транспортировка культуры
Культуру парамеций транспортируют в пробирках, не допуская перегрева и переохлаждения. Хранить ее без пересева можно в холодильнике при температуре 8 -
10 °С в течение 2 - 3 нед. Период акклимации к лабораторным условиям составляет 24 ч.
Приложение
Е
(обязательное)
Формы
представления результатов биотестирования
Е.1 Форма результатов биотестирования исследуемой воды по
реакции хемотаксиса Paramecium
caudatum
Таблица Е.1 -
Результаты биотестирования исследуемой воды по
реакции хемотаксиса Paramecium caudatum на территории деятельности
_________ УГМС
|
Наименование
|
Дата
|
Номер пробы
|
Положительный хемотаксис,
%
|
Оценка токсичности воды
|
|
Водного объекта
|
Пункта наблюдений
|
Отбора пробы
|
Проведения биотестирования
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
|
|
|
|
|
|
|
Примечание - В графе
7 пишут: «Оказывает острое
токсическое действие»
или «Не
оказывает острое
токсическое действие».
|
Е.2 Форма результатов биотестирования исследуемой воды по
показателю выживаемости зоопланктеров
Таблица Е.2 -
Результаты биотестирования исследуемой воды по
показателю выживаемости ____________________ на территории деятельности ___________
УГМС
вид
зоопланктера
|
Наименование
|
Дата
|
Номер пробы
|
Выживаемость, % от контроля
|
Оценка токсичности воды
|
|
Водного объекта
|
Пункта наблюдений
|
Отбора пробы
|
Проведения биотестирования
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
|
|
|
|
|
|
|
Примечания
1 В наименовании таблицы
указывают вид
использованного в
качестве тест-объекта зоопланктера
(парамеции, коловратки, дафнии, симоцефалюсы и
т.д.).
2
В графе
7 пишут: «Оказывает острое
токсическое действие»
или «Не
оказывает острое
токсическое действие».
|
Е.3 Форма результатов биотестирования по кратности разбавления исследуемой воды, снимающей острое токсическое действие
Таблица Е.3 - Результаты биотестирования по кратности разбавления исследуемой воды, снимающей острое токсическое действие, на
территории деятельности _______________ УГМС
|
Наименование
|
Дата
|
Номер пробы
|
Кратность разбавления
|
Положительный хемотаксис,
%
|
Оценка токсичности воды
|
|
Водного объекта
|
Пункта наблюдений
|
Отбора пробы
|
Проведения биотестирования
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
|
|
|
|
|
|
|
|
Примечание - В графе
8 пишут: «Оказывает острое
токсическое действие»
или «Не
оказывает острое
токсическое действие».
|
Приложение Ж
(справочное)
Библиография
[1]
Константинов А.С. Общая гидробиология. - М.: Высшая школа, 1986. - 470 с.
[2]
Методика определения токсичности почвы и донных осадков по
хемотаксической
реакции инфузорий. - М., 1998. - 22 с.
[3]
Федеральный закон РФ «О защите населения и территорий от чрезвычайных ситуациях природного и техногенного характера» от 21.12.94 № 68-ФЗ.
[4]
Правила охраны поверхностных вод (типовые положения). - М.: Госкосмприрода СССР, 1991
[5]
Брагинский Л.П. Некоторые принципы классификации пресноводных экосистем по уровням токсической загрязненности // Гидробиологический журнал. - 1985. - № 6, Т. 21. - С. 65 - 74.
[6]
Банина Н.Н. Тип Инфузории //Фауна аэротенков. Атлас. - П.: Наука, Ленингр., 1984. - С. 136 - 186.
[7] Бакаева Е.Н., Никаноров А.М. Гидробионты в оценке качества
вод. - М.: Наука, 2006. - 238 с.
Лист регистрации изменений
|
Номер изменения
|
Номер листа (страницы)
|
Номер документа (ОРН)
|
Подпись
|
Дата
|
|
измененного
|
замененного
|
нового
|
аннулированного
|
внесения изменений
|
введения изменений
|
|
|
|
|
|
|
|
|
|
СОДЕРЖАНИЕ
|
1 Область применения. 2
2 Нормативные ссылки. 2
3 Термины, определения
и обозначения. 3
4 Общие положения. 4
5 Основные принципы
биотестирования поверхностных вод суши в условиях ЧС.. 5
6 Отбор, хранение и
подготовка проб поверхностных вод суши для биотестирования. 6
7 Биотест по реакции
хемотаксиса парамеций. 7
7.1 Принцип метода. 7
7.2 Необходимые материалы, оборудование, реактивы.. 7
7.3 Подготовка к биотестированию.. 7
7.4 Проведение биотестирования. 7
7.5 Регистрация реакции хемотаксиса. 8
7.6 Обработка результатов, расчеты и оценка токсичности
воды.. 8
7.7 Метрологическая характеристика метода. 8
8 Биотест по выживаемости
зоопланктеров. 8
8.1 Принцип метода. 8
8.2 Необходимые материалы, оборудование, реактивы.. 9
8.3 Проведение биотестирования. 9
8.4 Регистрация показателя выживаемости и оценка
токсичности воды.. 9
9 Определение
кратности разбавления воды, снимающего острое токсическое действие воды.. 9
9.1 Биотест при разбавлении воды, снимающей ОТД.. 9
9.2 Оценка токсичности воды на основе кратности
разбавления пробы.. 10
10 Оценка токсичности
воды методом биотестирования с использованием набора биотестов. 10
11 Требования
безопасности, охраны окружающей среды.. 10
12 Требования к
квалификации оператора. 10
Приложение А (рекомендуемое)
Экологические характеристики гидробионтов, используемых в качестве
тест-объектов при биотестировании. 10
Приложение Б (рекомендуемое)
Гидробионты, используемые в качестве тест-объектов, и методы учета
популяционных характеристик. 12
Приложение В
(справочное) Хемотаксис. 12
Приложение Г
(справочное) Характеристика тест-объекта инфузории Paramecium
caudatum.. 13
Приложение Д
(справочное) Получение исходного материала и содержание парамеций в
лабораторных условиях. 14
Приложение Е
(обязательное) Формы представления результатов биотестирования. 15
Приложение Ж
(справочное) Библиография. 15
|