Государственное
санитарно-эпидемиологическое нормирование
Российской Федерации
Федеральная
служба по надзору в сфере защиты прав потребителей и благополучия человека
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Порядок применения молекулярно-
генетических методов при обследовании очагов
острых кишечных инфекций с групповой
заболеваемостью
Методические
указания
МУК
4.2.2746-10
Москва
2011
1. Методические указания разработаны Федеральной службой по
надзору в сфере защиты прав потребителей и благополучия человека (Е.Б. Ежлова,
Ю.В. Демина), ФГУН «Центральный научно-исследовательский институт
эпидемиологии» Роспотребнадзора (А.Т. Подколзин, К.В. Кулешов, Г.А. Шипулин,
В.В. Малеев, В.И. Покровский).
2. Рекомендованы к утверждению Комиссией по государственному
санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в
сфере защиты прав потребителей и благополучия человека.
3. Утверждены Руководителем Федеральной службы по надзору в
сфере защиты прав потребителей и благополучия человека, Главным государственным
санитарным врачом Российской Федерации Г.Г. Онищенко 30 сентября 2010 года.
4. Введены в действие с 30 сентября 2010 года.
5. Введены впервые.
СОДЕРЖАНИЕ
|
1. Область применения. 2
2. Список сокращений. 2
3. Общие положения. 2
4. Организация исследований. 3
5. Правила сбора, хранении и транспортировки
клинического материала и образцов объектов окружающей среды.. 5
6. Порядок проведения лабораторных исследований. 5
7. Нормативные ссылки. 8
Приложение 1. Сбор,
хранение и транспортировка материала для проведения молекулярно-генетических
исследований. 8
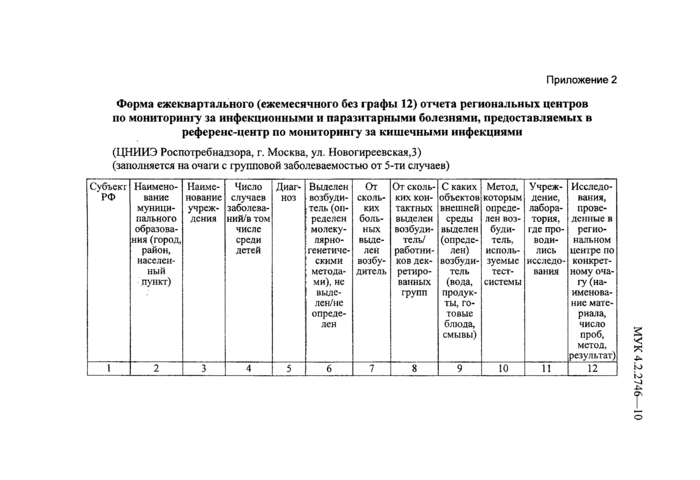
Приложение 2. Форма
ежеквартального (ежемесячного без графы 12) отчета региональных центров по
мониторингу за инфекционными и паразитарными болезнями, предоставляемых в
референс-центр по мониторингу за кишечными инфекциями. 9
|
|
|
УТВЕРЖДАЮ
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей
и благополучия человека,
Главный
государственный санитарный
врач Российской Федерации
Г.Г.
Онищенко
30 сентября 2010 г.
Дата
введения: с момента утверждения
|
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Порядок
применения молекулярно-генетических
методов при обследовании очагов острых кишечных
инфекций с групповой заболеваемостью
|
Методические
указания
МУК
4.2.2746-10
|
1. Область применения
1.1. В настоящих методических указаниях определены порядок
применения молекулярно-генетических методов исследования, а также сбора,
упаковки, хранения и транспортирования биологического материала и образцов
объектов окружающей среды (ООС) при обследовании очагов острых кишечных
инфекций с групповой заболеваемостью различной этиологии, вызванных ПБА III -
IV группы, не относящимися к условно-патогенной флоре (УПФ).
1.2. Методические указания предназначены для специалистов
органов и учреждений Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека, а также могут быть использованы
лечебно-профилактическими и другими учреждениями, независимо от ведомственной
принадлежности и организационно-правовой формы.
2. Список сокращений
ВОЗ - всемирная организация здравоохранения
ЖКТ - желудочно-кишечный тракт
ОКИ - острые кишечные инфекции
ООС - объекты окружающей среды
ОТ-ПЦР - полимеразная цепная реакция с обратной
транскрипцией
ПБА - патологические биологические агенты
ПЦР - полимеразная цепная реакция
УПФ - условно-патогенная флора
AFLP - оценка полиморфизма длинны фрагментов амплификации
EIEC - энтероинвазивные Е. coli
LCR - лигазная цепная реакция
MLST - мультилокусное секвенирование-типирование
NASBA - метод изотермической амплификации РНК (Nucleic
Acids Seaquencence Amplification)
PFGE - электрофорез в пульсирующем поле
RAPD - амплификации со случайными праймерами
VNTR - амплификация тандемных повторов с переменной
копийностью
3. Общие положения
К молекулярно-генетическим методам исследования относятся
методы выявления и характеристики инфекционных агентов на основе исследования
их нуклеиновых кислот с применением или без применения амплификационных
технологий путем определения наличия, размера и нуклеотидного состава различных
элементов генома возбудителя, либо сочетания этих подходов.
Наибольшее распространение получили амплификационные методы
на основе полимеразной цепной реакции (ПЦР). Для выявления ее продуктов
применяются методы гель-электрофореза, гибридизации с флуоресцентно-меченными
зондами, гибридизационно-ферментное выявление продуктов ПЦР и способы детальной
характеристики продукта с применением нуклеотидных биочипов и метода прямого секвенирования
нуклеотидных последовательностей продуктов реакции.
Достаточно широкое распространение имеют также методы
анализа генома возбудителя без применения амплификационных технологий. Наиболее
распространенным из них является метод электрофореза в пульсирующем поле.
Применение молекулярно-генетических методов исследования
должно рассматриваться не как альтернатива, а как обязательное дополнение к
регламентированным схемам диагностики острых кишечных инфекций, позволяющее
оперативно выявлять комплекс возбудителей ОКИ и проводить оценку идентичности
бактериальных и вирусных изолятов.
4. Организация исследований
4.1. Молекулярно-генетические методы исследования в очагах
ОКИ с групповой заболеваемостью применяются для решения следующих задач:
• наиболее раннего установления этиологии заболеваний с
целью своевременного начала адекватной терапии и проведения соответствующих
санитарно-противоэпидемических (профилактических) мероприятий;
• выявления ДНК/РНК возбудителей в предполагаемых факторах
передачи и источниках инфицирования;
• оценки идентичности изолятов возбудителей, выделенных из
различных материалов с целью определения источников инфицирования и факторов
передачи инфекции.
4.2. Применение молекулярно-генетических методов
исследования является обязательным в случае исследования материала из очагов
ОКИ с групповой заболеваемостью:
• при регистрации в очаге групповой заболеваемости ОКИ
летальных исходов от данных заболеваний, в том числе установленной этиологии;
• при отсутствии выделения от пациентов (> 30 %
обследованных) безусловных патогенов в эпидемически значимых количествах в
сроки, регламентированные действующими нормативно-методическими документами;
• при выделении от больных только условно-патогенной флоры в
единичных случаях, без достоверно выявленного фактора передачи возбудителя;
• при проведении детекции вирусных агентов в материалах из
окружающей среды, продуктов питания или лиц - предполагаемых источников
инфицирования (если такая область применения регламентируется производителем
диагностических препаратов);
• при проведении оценки идентичности изолятов
микроорганизмов, выявленных из различных источников и нерезультативном
применении при этом комплекса классических микробиологических и серологических
методик.
4.3. При работе в эпидемических очагах ОКИ формирование
панели образцов для исследования с определением количества обследуемых больных,
лиц, подвергшихся риску заражения, декретированного контингента, образцов ООС и
выделенных изолятов возбудителей определяется специалистами, уполномоченными
осуществлять государственный санитарно-эпидемиологический надзор в соответствии
с действующими нормативно-методическими документами.
4.4. Для обеспечения контроля качества проводимых
исследований целесообразно дополнительно направлять на исследование клинический
материал от лиц без клинических проявлений заболевания, не имеющих
эпидемиологической связи с обследуемым очагом в количестве ~ 20 % от количества
лиц, имеющих эпидемиологическую связь с очагом в виде единой зашифрованной
отправителем панели. Клинический материал от лиц - предполагаемых источников
инфицирования не подлежит зашифровке в целях правильной организации
лабораторных исследований.
4.5. Первичное молекулярно-генетическое исследование
(ПЦР-диагностика) клинического материала от больных проводится в лабораториях
лечебно-профилактических учреждений (ЖГУ), ФГУЗ «Центр гигиены и эпидемиологии»
в субъекте Российской Федерации, имеющих в своем составе ПЦР-лаборатории.
4.6. Первичное молекулярно-генетическое исследование
предполагаемых источников инфицирования, лиц, подвергшихся заражению и ООС
осуществляют на базе ФГУЗ «Центр гигиены и эпидемиологии» в субъекте Российской
Федерации, имеющих в своем составе ПЦР-лаборатории.
4.7. Региональные центры по мониторингу за возбудителями
инфекционных и паразитарных болезней (региональные центры) Роспотребнадзора
проводят исследования по оценке идентичности возбудителей, выявленных у
пострадавших, лиц - предполагаемых источников инфицирования и ООС (при наличии
необходимого оборудования и квалификации персонала), а также оказывают помощь
ФГУЗ «Центр гигиены и эпидемиологии» в субъектах Российской Федерации при
исследовании больших объемов материала. Оценка идентичности культур
микроорганизмов проводится только в отношении тех штаммов, которые были
расценены как идентичные при проведении микробиологической диагностики.
При невозможности проведения работ по оценке идентичности
изолятов в условиях региональных центров Роспотребнадзора, материал для данных исследований
направляется в референс-центр по мониторингу за возбудителями острых кишечных
инфекций (ФГУН «Центральный научно-исследовательский институт эпидемиологии»
Роспотребнадзора, 111123, г. Москва, ул. Новогиреевская, 3).
4.8. При получении отрицательных результатов первичного
исследования клинического материала от больных и при получении дискордантных
результатов исследований в региональных центрах, первичный клинический
материал, образцы проб ООС и выделенные культуры возбудителей направляются для исследования
в референс-центр по мониторингу за возбудителями острых кишечных инфекций.
4.9. Референс-центр по мониторингу за возбудителями острых
кишечных инфекций оказывает информационно-методическую поддержку деятельности
органов и учреждений Роспотребнадзора.
4.10. ФГУЗ «Центр гигиены и эпидемиологии» в субъектах
Российской Федерации ежемесячно представляют информацию об этиологической
расшифровке очагов ОКИ с групповой заболеваемостью (от 5-ти случаев) в
региональные центры по мониторингу за инфекционными и паразитарными болезнями
(прилож. 2 без графы 12).
4.11. Региональные центры Роспотребнадзора ежеквартально (до
15-го числа следующего месяца) направляют информацию о результатах
этиологической верификации очагов ОКИ с групповой заболеваемостью в
референс-центр по мониторингу за возбудителями острых кишечных инфекций в
разрезе курируемых территорий.
4.12. Референс-центр по мониторингу за возбудителями острых
кишечных инфекций ежегодно (до 15-го марта следующего за отчетным года)
направляет в Федеральную службу по надзору в сфере защиты прав потребителей и
благополучия человека отчет о регистрации и этиологической верификации очагов
ОКИ с групповой заболеваемостью на территории Российской Федерации, а также рекомендации
по совершенствованию применяемых при их расследовании методов лабораторной
диагностики.
5. Правила сбора, хранении и транспортировки
клинического материала и образцов объектов окружающей среды
5.1. Сбор хранение и транспортировка клинического материала
и образцов ООС осуществляется врачами ЛПУ и специалистами, уполномоченными
осуществлять государственный санитарно-эпидемиологический надзор в соответствии
с действующими нормативно-методическими документами (раздел № 7) и инструкциями
к используемым тест-системам.
5.2. Лабораторным исследованиям подлежат следующие
материалы:
• клинический материал от пострадавших лиц, полученный в
первые 72 ч от начала заболевания и не позднее 1 дня госпитализации (фекалии,
взятые в объеме 2 - 5 мл), рвотные массы, по согласованию - мазки из ротоглотки
и другие типы клинического материала);
• аутопсийный материал (фекалии, фрагменты стенки различных
отделов ЖКТ);
• клинический материал от лиц - предполагаемых источников
инфицирования (фекалии, взятые в объеме 2 - 5 мл, или ректальные мазки (прилож.
1), рвотные массы, по согласованию -
образцы крови и другие типы клинического материала). Сбор ректальных мазков
следует проводить только при невозможности получения фекалий в виде объемной
пробы;
• образцы объектов окружающей среды (ООС), как
предполагаемых факторов передачи заболевания. Объем выборки ООС (продукты
питания, концентраты образцов воды) определяется специалистами, уполномоченными
осуществлять государственный санитарно-эпидемиологический надзор. При
исследовании продуктов питания обязательным является исследование смывов с их
упаковок, поэтому продукты питания для исследования необходимо предоставлять в
целой упаковке;
• культуры штаммов микроорганизмов, выделенных при проведении
исследований клинического материала или ООС на транспортных средах.
5.3. Не допускается транспортировка клинического материала
от больных и выделенных культур микроорганизмов в одном контейнере с образцами
ООС и материалом от лиц - предполагаемых источников инфицирования.
5.4. В учреждении, осуществляющем первичное исследование
материала, каждый образец клинического материала и ООС делится на две части,
одна из которых подвергается исследованию, а другая хранится для обеспечения
возможности ее исследования в региональном центре или референс-центре по
мониторингу за возбудителями острых кишечных инфекций.
6. Порядок проведения лабораторных исследований
6.1. Лабораторные исследования проводятся в соответствии с
действующими нормативно-методическими документами.
6.2. Лабораторные исследования для установления этиологии
заболеваний, и выявления аналогичных возбудителей в ООС и лиц - предполагаемых
источников инфицировании, организуемые на базе лабораторий ЛПУ, ФГУЗ «Центр
гигиены и эпидемиологии» в субъектах Российской Федерации и Региональных
центрах Роспотребнадзора проводят с использованием диагностических тест-систем,
разрешенных к применению на территории Российской Федерации в установленном
порядке.
Для выявления патогенов методом ПЦР (ОТ-ПЦР) предпочтение
должно отдаваться диагностическим тест-системам, которые обеспечивают
максимальную контаминационную безопасность исследований (тест-системы с
гибридизационно-флуоресцентной детекцией, с возможностью использования
деконтаминационных процедур на основе принципа пост-ПЦР стерилизации).
Референс-центр по мониторингу за возбудителями острых
кишечных инфекций использует в своей работе весь доступный комплекс
молекулярно-генетических методик.
6.3. Минимальный спектр исследований
клинического материала от пострадавших при вспышках ОКИ должен включать
детекцию:
• норовирусов 2 генотипа;
• ротавирусов группы А;
• микроорганизмов рода Shigella и энтероинвазивных Е.
coli (ЕIЕС);
• микроорганизмов рода Salmonella;
• термофильной группы микроорганизмов рода Campylobacter.
Для детекции ротавирусов группы А в клиническом материале
могут альтернативно применяться диагностические тест-системы на основе ИФА или
латекс-агглютинации при наличии данных о их валидации относительно тест-систем,
рекомендованных для использования ВОЗ (Базовые протоколы оценки бремени
ротавирусных гастроэнтеритов по данным госпитализации и изучения обращаемости
детей за медицинской помощью по поводу гастроэнтеритов на уровне обслуживаемого
населения).
Для детекции перечисленных групп бактериальных возбудителей
обязательно параллельное применение бактериологической диагностики, проводимой
в соответствии с действующими нормативно-методическими документами, с
получением чистых культур возбудителей для возможного проведения впоследствии
оценки их идентичности.
6.4. При неинформативности исследования на первичный спектр
микроорганизмов (п. 6.3) или наличии
дополнительных клинико-эпидемиологических данных в данный спектр исследований целесообразно
включать возбудителей астровирусной инфекции, аденовирусной инфекции,
тифо-паратифозных заболеваний, иерсиниозов, эшерихиозов.
При наличии клинико-эпидемиологических данных не позволяющих
исключить у пациента холеру, лабораторное исследование материала проводится в
соответствии с действующими нормативно-методическими документами.
6.5. Лабораторное исследование материала от пострадавших на
наличие возбудителей острых кишечных инфекций вирусной и бактериальной
этиологии, вызванных ПБА III - IV группы проводится в течение 24-х часов с
момента его поступления в лабораторию. При поступлении в лабораторию большого
количества образцов и невозможности их исследования в указанные сроки в полном
объеме, специалистами лаборатории формируется репрезентативная выборка (не
менее 20 образцов), исследование которой производится в вышеуказанные сроки, с
последующим проведением полного объема исследований.
6.6. Лабораторные исследования по установлению идентичности
изолятов микроорганизмов проводятся с применением молекулярно-генетических
методик, обеспечивающих:
• необходимую для исследований разрешающую способность
(способность дифференцировки штаммов микроорганизмов, циркулирующих на данной
территории);
• межлабораторную воспроизводимость результатов исследований;
• низкий риск получения невалидных результатов исследования
в комплексе с применением диагностических тест-систем.
6.7. В отношении возбудителей вирусной этиологии
используются методы, основанные на прямом секвенировании вариабельного участка
(участков) их генома. Для исключения получения ложноположительных результатов,
методом прямого секвенирования исследуются смещенные или альтернативные по
отношению к используемым для диагностики области генома возбудителя.
Предпочтение должно отдаваться методикам, позволяющим провести исследование
возможно более протяженного участка генома возбудителя.
6.8. В отношении возбудителей бактериальной этиологии,
используются методы, минимизирующие возможность субъективной оценки их
результатов. Предпочтение должно отдаваться широко используемым в мире
методикам, позволяющим провести сопоставление получаемых результатов с
международными данными (мультилокусное секвениро-вание-типирование - MLST
и его варианты, амплификация тандемных повторов с переменной копийностью - VNTR
и его варианты, электрофорез в пульсирующем поле - PFGE, оценка
полиморфизма длинны фрагментов амплификации - AFLP). Желательно более
широкое применение методик основанных на прямом секвенировании участка
(участков) генома возбудителя, как методик обеспечивающих абсолютную
воспроизводимость исследований.
Не рекомендуется применение методик, обладающих низкой
межлабораторной воспроизводимостью - например амплификации со случайными
праймерами (RAPD) или низкой дифференцирующей способностью.
6.9. При необходимости проведения одновременного
исследования клинического материала от пострадавших и материалов с потенциально
редким или низким содержанием возбудителя (ООС, предполагаемые источники
инфицирования) придерживаются следующей последовательности выполнения работ:
1. Обработка материала и выделение нуклеиновых кислот (без
проведения детекции патогенов) из образцов с потенциально редким или низким
содержанием возбудителя (ООС, лица - предполагаемые источники инфицирования).
2. Обработка и исследование материала от пострадавших лиц и
установление доминирующего возбудителя или доминирующих возбудителей.
3. Тестирование проб ООС и материала от лиц - предполагаемых
источников инфицирования на наличие доминирующего патогена или патогенов.
При проведении лабораторной диагностики заболеваний данной
группы следует учитывать, возможную крайне высокую концентрацию их возбудителей
в клиническом материале и высокий риск перекрестной контаминации образцов при
нарушении правил их хранения, транспортировки и обработки. Особенно характерным
это является для ротавирусов и аденовирусов.
6.10. При проведении исследования продуктов питания на
содержание ПБА наряду с самим продуктом исследуются смывы с его упаковки.
6.11. При тестировании материалов с потенциально редким или
низким содержанием возбудителя с применением тест-систем на основе
амплификационных технологий количество отрицательных контролей, прошедших все
этапы исследований, должно составлять не менее 20 % от количества исследуемых
образцов.
6.12. По результатам проведенных исследований оформляется
заключение в котором должна быть представлена следующая информация:
• количество, характер поступивших на исследование образцов
и их состояние после транспортировки (особое внимание должно уделяться
состоянию целостности первичных контейнеров и упаковок продуктов питания);
• перечень использованных тест-систем;
• полученные результаты исследования.
При проведении исследования части образцов оформляется
предварительное заключение, в котором дополнительно приводятся сведения о доле
исследованных образцов.
6.13. В заключении, оформляемом по результатам оценки
идентичности изолятов, должна быть представлена следующая информация:
• количество, состояние полученных культур микроорганизмов;
• краткое описание используемой методики, с указанием
используемого оборудования и программного обеспечения, при использовании метода
прямого секвенирования - размеров и расположения анализируемых участков генома;
• при использовании методик, результаты которых имеют форму
паттернов (VNTR, AFLP, PFGE) - графическое представление полученных
результатов.
6.14. Организации, ответственные за проведение данных
разделов работы сохраняют образцы клинического материала и ООС, культуры
микроорганизмов и результаты исследований в виде первичных материалов (файлы,
полученные на детектирующих приборах) до оформления окончательного донесения о
очаге инфекционного заболевания с групповой заболеваемостью, а при проведении
комиссионной судебной экспертизы в рамках уголовного дела - до истечения срока
обжалования решения суда.
7. Нормативные ссылки
1. СП
1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности
(опасности) и возбудителями паразитарных болезней» с дополнением СП 1.3.2518-09
от 02.06.2009 № 42.
2. СП
1.2.036-95 «Порядок учета, хранения, передачи и транспортирования
микроорганизмов I - IV групп патогенности».
3. МУ
1.3.2569-09 «Организация работы лабораторий, использующих методы
амплификации нуклеиновых кислот при работе с материалом, содержащим
микроорганизмы I - IV групп патогенности».
4. МУК 4.2.2029-05.
«Методические указания по санитарно-вирусологическому контролю водных
объектов».
5. МУ 4.2.2218-07 «Лабораторная
диагностика холеры»
6. ГОСТ
26668-85 «Методы отбора проб для микробиологических анализов»
7. ГОСТ
Р ИСО 7218-2008 «Микробиология пищевых продуктов и кормов для животных.
Общие требования и рекомендации по микробиологическим исследованиям»
Приложение
1
Сбор, хранение и транспортировка материала для
проведения молекулярно-генетических исследований
Фекалии
Пробу фекалий (1,0 - 2,0 г) у грудных детей забирают из
подгузника у пациентов старшего возраста - из помещенного в горшок или
подкладное судно одноразового полиэтиленового пакета или одноразовой
пластиковой емкости (чашка Петри). Затем в количестве 1,0 г (примерно)
переносят в специальный стерильный контейнер. Контейнер с материалом
доставляется в лабораторию в емкости со льдом в течение 1 суток.
Условия хранения и транспортировки материала:
• при температуре 2 - 8 °С - в течение 1 суток;
• при температуре минус 20 °С - в течение 1 недели.
Допускается только однократное замораживание-оттаивание
материала.