МУК 4.1.1393—03
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации,
Первый заместитель Министра здравоохранения Российской Федерации Г. Г. Онищенко
24 июня 2003 г.
Дата введения: 30 июня 2003 г.
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств Мезотриона в воде, почве, зеленой массе и зерне кукурузы методом газожидкостной хроматографииМетодические указания _МУК 4.1.1393—03_
1. Вводная часть
Фирма-производитель: ООО Сингента.
Торговое название: WF 2795
I 1азвание действующего вещества по ИСО: Мезо грион Название действующего вещества по ИЮПАК: 2-(4-мезил-2-ни гробензоил)пикло1 ексан-1,3-дион Структурная формула:
Эмпирическая формула: C14H13NO7S М. м. 339,3
Химически чистый Мезогрион представляет собой бледно-желтый порошок без запаха.
Давление паров: 5,69 х 10‘3 мПа при 20 °С.
Температура плавления: 165,3 °С.
Растворимость в воде - 2,2 (pH 4,8), 15 (pH 6,9), 22 (pH 9) г/л (при 20 °С).
1
МУК 4.1.1393—03
Растворимость в органических растворителях: 1,2-дихлорэтан -66,3; этилацетат - 18,6; метанол - 4,6; толуол - 3,1 г/кг;
Константа диссоциации рКа - 3,12 при 20 °С.
Стабилен к гидролизу в стерильных условиях при pH 5—9 и фотолизу в воде.
Сохранность и подвижность в почве сильно зависит от pH и содержания органического вещества. К^ колеблется от 387 при pH - 4,6 до 19 при pH - 7,0; ДТ50 - от 4 дн. при pH 7,7 и % орг. утл. 0,9 до 31,5 дн. при pH 5,0 и % орг. угл. 2,0.
Краткая токсикологическая характеристика. Мезотрион относится к малоопасным для человека и теплокровных животных веществам по оральной (ЛД$о для крыс >5000 мг/кг) дермальной токсичности (ЛД$о для крыс >2000 мг/кг) и к умеренно опасным веществам но ингаляционной токсичности (ЛК$о для крыс >5 мг/л).
В России гигиенические нормативы не установлены.
Область применения. Мезотрион - системный гербицид из класса трикетонов, хороню проникающий в растение через корни и листья и передвигающийся в растениях в обоих направлениях - базипсталмю и акропетально. Эффективно подавляет двудольные однолетние и некоторые злаковые сорняки путем ингибирования биосинтеза каратиноидов в посевах кукурузы при нормах расхода 100—25 г/га (до всходов культуры) и 70—150 г/га (но всходам кукурузы).
2. Методика определении остаточных количеств Мезотриопа в воде, почве, зеленой массе и зерне кукурузы газохроматографическим мегодом
2.1. Основные положения
2.1.1. Принцип .метода
Методика основана на определении Мезотриопа методом газожидкостной хроматографии с использованием детектора но захвату элск-тронов (ДПР, ДЭЗ) после его экстракции из объектов анализа органическим растворителем, очистки экстракта перераспределением действующего вещества между несмешивающимися фазами, гидролиза Мезотри-она до 4-(метилсульфонил)-2-нитробснзойной кислоты с последующим получением ее метилового эфира.
Идентификация вещества проводится по времени удерживания, а количественное определение - мегодом абсолютной калибровки.
МУК 4.1.1393—03
Промытую эфиром волную фазу сливают в стакан, и подкисляют сс концентрированной хлороводородной кислотой до pH = 2, добавляя кислоту по каплям при интенсивном перемешивании пробы стеклянной палочкой или механической мешалкой. (Осторожно! Возможно вспенивание!)
Подкисленную водную фазу переносят в чистую делительную воронку и встряхивают, удаляя остатки СОг- После этого в делительную воронку наливают 50 мл этилацетата и реэкстрагируют Мезотрион в этилацетат, встряхивая воронку 1—2 мин. После разделения фаз нижнюю водную фазу сливают в стакан емкостью 250 мл, а этилацетат собирают в концентратор, пропуская его через безводный сульфат натрия. Водную фазу возвращают в делительную воронку и повторяют экстракцию еще два раза порциями этилацетата по 50 мл. Объединенные в конце! преторе порции этилацетата упаривают досуха на ротационном вакуумном испарителе при температуре 50 °С.
Сухой остаток растворяют в 1—2 мл ацетона, тщательно обмывают стенки концентратора и переносят раствор Пастеровской пинеткой в виалу. Концентратор ополаскивают небольшими порциями ацетона еще 2 раза, собирая ацетон в ту же виалу.
Из виалы ацетон удаляют током теплого воздуха. После этого сухой остаток заливают 2 мл реактива Джонса (п. 2.3.2.1), виалу плотно закрывают крышкой и проводят гидролиз пробы е последующей псрс-экстракцией продуктов гидролиза в этилацетат, как указано в п. 2.3.3.1 и ее метилирование, как указано в п. 2.3.3.2.
По окончании метилирования эфир из концентратора удаляют током воздуха или азота. Сухой остаток в концентраторе разводят в 5 мл толуола.
2.5.3. Зеленая масса кукурузы
Навеску измельченного растительного материала 10 г помещают в пластиковую банку емкостью 250 мл, заливают 50 мл смеси ацетонитрил: вода - 1 : 1 и экстрагируют Мезотрион в течение 30 мин на ве гря-хивателе. Экстракт филыруют через бумажный фильтр в концентратор емкостью 250 мл. Оке гракцию повторяют еще раз, используя 50 мл экс-трагирующей смеси, и встряхивая пробу в течение 30 мин. Экстракт фильтруют в тот же концентратор. Объединенный экстракт упаривают на ротационном вакуумном испарителе до водного остатка при температуре не выше 40 °С. (Осторожно! При интенсивном вскипании пробы возможен се переброс в приемную колбу!).
К водному остатку в концентраторе добавляют 30 мл 5 %-ного водного раствора бикарбоната ма фия, подщелачивая раствор до pH = 8, перемешивают содержимое и отфильтровывают через бумажный фильтр в делительную воронку емкостью 500 мл. Концентратор обмывают 50 мл дистиллированной воды и отфильтровывают сс в ту же делительную воронку. К содержимому воронки добавляют еще 100 мл дистиллированной воды, 5 г хлорида мафия и 30 мл диэтилового эфира.
Далее анализ проводят но схеме, указанной в п.2.5.2.2.
2.5.4. Зерно кукурузы
Навеску измельченного зерна 10 г помещают в пластиковую банку емкостью 250 мл, заливают 50 мл смеси ацетонитрил : вода -1 : 1 и экс-фагируют Мсзофион, как указано в п. 2.5.2. Объединенный эксфакт упаривают на ротационном вакуумном испарителе до водного остатка при температуре не выше 40 °С. (Осторожно! При интенсивном вскипании пробы возможен ее переброс в приемную колбу!).
Далее анализ проводят но схеме, указанной в п. 2.5.2.2.
2.6. Условия хроматографирования и обработка результатов
2.6.1. Условия хроматографирования
Хроматограф «Кристалл 2000 м» с элекгронозахватным детектором (ОЗД 63Ni) с пределом детектирования по Линдану 5 10'14 г/см3.
Колонка капиллярная кварцевая HP-5 (Crosslinked 5% PH ME Siloxane), длина 15 м, внутренний диаметр 0,32 мм, толщина пленки 0,25 мкм.
Температура термостата колонки программированная. Начальная температура - 180 °С, выдержка 3 мин; нагрев колонки но 2 градуса в минуту до температуры 200 °С, выдержка 7 мин; нагрев колонки но 30 градусов в минуту до температуры 260 °С выдержка 4 мин.
Температура испарителя - 250 °С, детектора - 320 °С.
Газовый режим - Нормальный.
Газ-носитель - гелий (Г1). Тип регулятора расхода гелия - РРГ 11, линейная скорость - 20 см/с, давление на входе 28,56 кПа.
Газ 2 (Г2) - гелий (продувка испарителя), расход 1 мл/мин, сброс 1 : 20.
Газ 3 (ГЗ) - азот (поддув в детектор), расход во время анализа - 35 мл/мин.
12
МУК 4.1.1393—03
Продувка системы после анализа при температуре 260 °С в течение
4 мин: продувка испарителя гелием - 50 мл/мин; продувка детектора азотом - 65 мл/мин.
Абсолютное время удерживания Мезотриона - 9 мин 52 с - 10 мин
05 с.
Объем вводимой пробы - 1 мкл.
Линейность детектирования сохраняется в пределах 0,05—0,5 нг. Образцы, дающие пики большие, чем стандартный раствор е концентрацией 0,5 мкг/мл, разбавляют.
2.6.2. Обработка результатов анализов
Содержание Мезотриона в пробах воды, почвы, зеленой массе и зерне кукурузы рассчитывают методом абсолютной калибровки по формуле:
X- содержание Мезотриона в пробе, мг/кг или мг/л;
II{- высота ника образна, мм;
IIQ- высота пика стандарта, мм;
Л - концентрация стандартного раствора по Мезотриону, мкг/мл;
V - объем экстракта, подготовленного для хромакнрафирования
(мл);
т - масса или объем анализируемого образца, г или мл.
Р - содержание Мезотриона в аналитическом стандарте.
3. Требовании техники безопасности
Необходимо соблюдать общепринятые правила безопасности при работе с органическими растворителями, токсичными веществами, элекгрона1реватсльными приборами и сжатыми газами.
4. Разработчики
Калинин В. А., проф., к. с-х. н., Калинина Г. С., к. с-х. и., Довгилс-вич А. В., к. хим. н., Фролова Н. С.
Московская сельскохозяйственная академия им. К. А. Тимирязева. Учебно-научный консультационный центр «Агроэкология пестицидов и агрохимикатов», 127550, Москва, Тимирязевская ул. д. 53, стр. 1, Теле-фон/факс: 976-37-68 / 976-43-26.
13
МУК 4.1.1393—03
2.1.2. Избирательность метода
В предлагаемых условиях метод специфичен в присутствии пестицидов, применяемых при возделывании кукурузы.
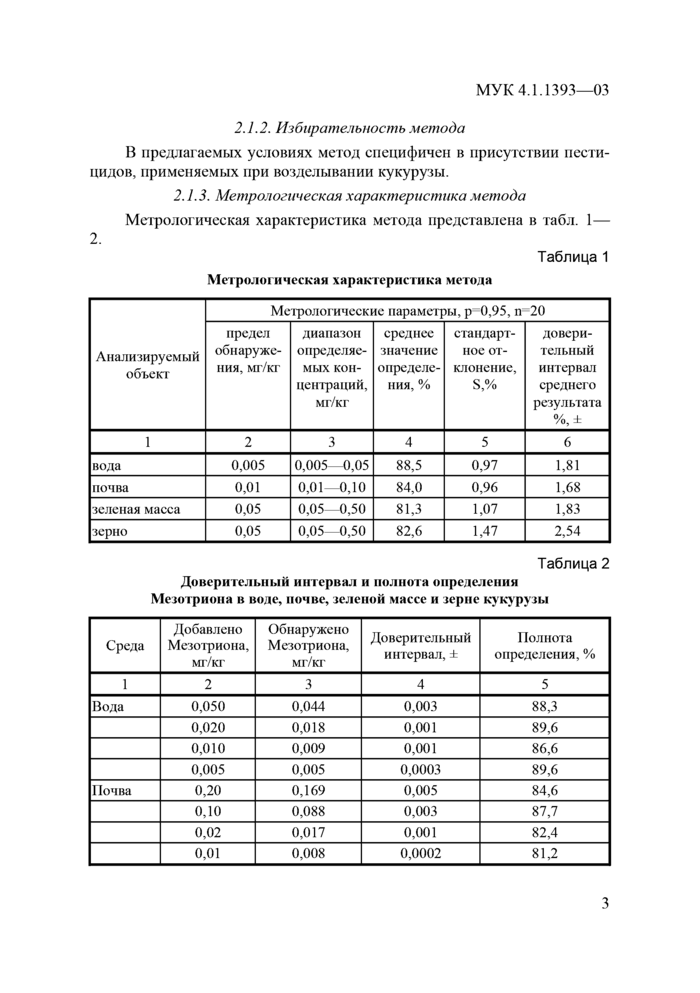
2.1.3. Метрологическая характеристика метода Метрологическая характеристика метода представлена в табл. 1—
2.
Мезро.км ическая характеристика метола
|
Таблица 1 |
|
Анализируемый
объект |
Метрологические параметры, р 0,95, п 20 |
|
предел обнаружения, мг/кг |
диапазон определяемых концентраций, мг/кг |
среднее значение определения, % |
стандартное отклонение, S,% |
довери
тельный
интервал
среднего
результата
%,± |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
вода |
0,005 |
0,005—0,05 |
88,5 |
0,97 |
1,81 |
|
почва |
0,01 |
0,01—0,10 |
84,0 |
0,96 |
1,68 |
|
зеленая масса |
0,05 |
0,05—0,50 |
81,3 |
1,07 |
1,83 |
|
зерно |
0,05 |
0,05—0,50 |
82,6 |
1,47 |
2,54 |
|
Доверительный интервал и полнота определении Мезотриона в воде, почве, зеленой массе и зерне кукурузы
|
Таблица 2 |
|
Среда |
Добавлено
Мезотриона,
мг/кг |
Обнаружено
Мезотриона,
мг/кг |
Доверительный интервал, ± |
Полнота определения, % |
|
1 |
2 |
3 |
4 |
5 |
|
Вода |
0,050 |
0,044 |
0,003 |
88,3 |
|
|
0,020 |
0,018 |
0,001 |
89,6 |
|
|
0,010 |
0,009 |
0,001 |
86,6 |
|
|
0,005 |
0,005 |
0,0003 |
89,6 |
|
Почва |
0,20 |
0,169 |
0,005 |
84,6 |
|
|
0,10 |
0,088 |
0,003 |
87,7 |
|
|
0,02 |
0,017 |
0,001 |
82,4 |
|
|
0,01 |
0,008 |
0,0002 |
81,2 |
|
|
Продолжение таблицы 2 |
|
1 |
2 |
3 |
4 |
5 |
|
зеленая
масса |
0,50 |
0,400 |
0,008 |
79,9 |
|
|
0,20 |
0,162 |
0,005 |
80,9 |
|
|
0,10 |
0,083 |
0,006 |
83,1 |
|
|
0,05 |
0,041 |
0,004 |
81,2 |
|
зерно |
0,50 |
0,401 |
0,017 |
80,2 |
|
|
0,20 |
0,165 |
0,005 |
81,9 |
|
|
0,10 |
0,084 |
0,003 |
83,4 |
|
|
0,05 |
0,043 |
0,006 |
85,1 |
|
|
2.2. Реактивы, растворы, материалы и оборудование |
2.2.1. Реактивы, материалы и растворы
Мезотрион, аналитический стандарт
фирмы Сингента с содержанием д.в. 99,7 %
Азот, осч
Ацетон
Ацетонитрил
Вода бидистиллированная, деионизированная*.
Гелий марки «А»,
Калия гидроксид, чда Кислота серная, концентрированная, хч Кислота хлороводородная, концентрированная, хч Медь серно-кислая, ч Метиламин соляно-кислый, ч Мочевина, чда Натрия нитрит, хч
Натрий серно-кислый, безводный, хч Нагрий хлористый, хч Толуол, хч
Хромовый ангидрид, ч Этилацетат, хч
Эфир диэтиловый, хч ГОСТ 6265-74
* Бидистиллят кипятят в течение 6 ч е марганцово-кислым калием, добавленным из расчета 1 г/л и затем перегоняют
2.2.2. Приборы, аппаратура, посуда
Аппарат для встряхивания, или аналогичный Баня водяная
Банки е крышками для экстракции на 250 мл, полипропилен, кат. № 3120-0250, NALGENE Весы аналитические ВЛА-200, или аналогичные Весы лабораторные,
Виалы (пузырьки) с тефлоновыми прокладками емкостью 40 мл, кат. № Z 27,702—9, Aldrich Водоструйный насос Воронки делительные на 250 и 500 мл Воронки ;ыя фильтрования, стеклянные Испаритель ротационный, вакуумный ИР-1М, или аналогичный Колонка капиллярная кварцевая HP-5 (Crosslinked 5 % PH ME Siloxane), длина 15 м Колбы конические плоскодонные на 100 и 250 мл, K1IIII-250 Колбы мерные на 10, 25, 50, 100 мл Концентраторы 1рушсвидныс НШ29 КГУ-100 (250)
Микропипетки на 0,1 мл Микрошприц на 10 мкл НагpcBaicльный блок дзя виал,
Dri-Bloek DB-3, Tecam Насос водоструйный Пинетки мерные на 1,0; 2,0 и 5,0 мл Пипетки Пастеровские длиной 230 мм, Z 31,073—5, Aldrich.
Стаканы химические на 250 мл
ТУ 64-1-1081—73 ТУ 46-22-603—75
Фильтры бумажные «красная лента» ТУ 6-09-1678—86
Хроматограф газовый «Кристалл 2000М» с электронно-захватным детектором (ЭЗД) с пределом детектирования но Линдану не выше 4 • 10'" и набором приспособлений для капиллярной колонки или аналогичный
IЦентрифуга, или аналогичная МРТУ 42-219 - 69
Цилиндры мерные на 25, 50 и 100 мл ГОСТ 1770-74
2.3. Подготовка к определению
2.3.1. Подготовка и кондиционирование колонки для газожидкостной хроматографии
Капиллярную колонку устанавливают в термостате хроматографа, не подсоединяя к детектору, и стабилизируют в токе гелия при температуре на 20 °С ниже предельного значения для выбранной неподвижной фазы в течение 8—10 ч.
2.3.2. Приготовление реактивов
2.3.2.1. Приготовление реактива Джонса для гидролиза.
В колбу объемом 250 мл наливают 154 мл дистиллированной воды, добавляют 14 мл концентрированной серной кислоты и 53,6 г хромового ангидрида (СгОз) и тщательно перемешивают. Хранят раствор при комнатной температуре.
2.3.2.2. Приготовление реактива А.
В колбу объемом 250 мл наливают 200 мл дистиллированной воды, добавляют 14 мл концентрированной серной кислоты и Юг сульфата меди, перемешивают до полного растворения соли. В полученный раствор добавляют 80 г сульфата натрия, перемешивают содержимое колбы 5—10 мин. Хранят при комнатной температуре.
2.3.2.3. Получение N-нитрозо-М-метилмочевины.
При отсутствии готового препарата N-нигрозометилмочевины осуществляют его синтез. Все работы необходимо проводить в вытяжном шкафу! В круглодонную колбу со шлифом емкостью 1 л, снабженную обратным холодильником, помещают 80 г метиламина гидрохлорида и 300 г мочевины, растворяют содержимое в 400 мл воды и кипятят 3 ч с образным холодильником на водяной бане. По истечении срока раствор в колбе охлаждают до комнатной температуры и добавляют в него 110 г нитрита натрия. Затем раствор охлаждают в бане со льдом или снегом, содержащим поваренную соль, до 0 °С. Охлажденный раствор мс;1ленно (Острожно! Вспенивание!) при перемешивании псрсли-
МУК 4.1.1393—03
вают в стакан емкостью 2 л, содержащий смесь 600 г льда и 60 мл концентрированной серной кислоты, охлаждаемый снаружи смесью льда с поваренной солью, следя :*а тем, чтобы температура внутри стакана не поднималась выше 2 °С. Всплывшие кристаллы нитрозометилмочевины немедленно отфильтровывают через фильтр в воронке Бюхнера иод вакуумом и промывают на фильтре ледяной водой.
Внимание! Нитрозометилмочевину хранят во влажном состоянии в темной склянке с пластмассовой пробкой в морозильнике, т. к. под действием света и тепла она может взорваться.
2.3.2.4. Приготовление раствора диазометана.
Внимание! Диазометан взрывоопасен и очень ядовит. Все работы необходимо проводить в вытяжном шкафу!
В коническую колбу на 100 мл вносят 20 мл 40 %-ного раствора гидроксида калия и 50 мл диэтилового эфира, колбу помешают в баню со льдом и охлаждают до температуры 2—4 °С. В охлажденную смесь порциями при перемешивании на магнитной мешалке или стеклянной палочкой вносят 5 г нитрозометилмочевины. Реакционную смесь выдерживают на холоде 10 мин. Затем эфирный слой сливают в чистую коническую колбу емкостью 100 мл, добавляют 10—15 гранул гидроксида калия и колбу оставляют в бане со льдом или холодильнике на 2— 3 ч для осушения раствора.
Раствор диазометана в эфире храню в морозильнике в течение 1— 2 суток. При хранении сосуды с раствором нельзя плотно закрывать!
2.3.3. Приготовление стандартных растворов
Взвешивают 50 мг Мсзотриона в мерной колбе на 50 мл, растворяют навеску в ацетоне и доводят объем до метки ацетоном (стандартный раствор № 1, концентрация 1 мг/мл).
Стандартный раствор № 1 можно хранить в холодильнике в течение 6 мсс.
Me го дом последовательного разбавления готовят стандартные растворы Мезотриона в ацетоне с концентрацией 0,5; 1,0; 2,0; и 5,0 мкг/мл для поегроения калибровочного фафика и внесения в контрольный образец.
2.3.3.1. Гидролиз стандартных растворов и проб.
Из полученных стандартных растворов Мезогриона отбирают по 1 мл и помещают в виалы или пузырьки с плотно закрывающимися крышками, имеющими тефлоновые прокладки. Содержимое виал высушиваю! в токе теплого воздуха, затем в каждый пузырек добавляют по 2 мл реактива Джонса (см. п. 2.3.2.1), закрывают виалы крышками и
перемешивают содержимое, обмывая етенки в нал. Помещают виалм в песчаную баню или драй-блок, нагретый до температуры 88—89 °С, и выдерживают их в течение 13 мин. Через 5 мин после начала гидролиза содержимое виал быстро перемешивают еще раз и продолжают гидролиз. Внимание! При гидролизе температура не должна опускаться ниже 85 °С.
По окончании гидролиза виалы охлаждают при комнатной температуре. В каждую виалу добавляю! но 10 мл деионизированной бидистил-лированной воды, 2—3 г сульфата натрия и 10 мл этилацетата, плотно закрывают крышками, встряхивают еодержимое виал в течение 30 с и оставляют на 5 мин для полного разделения слоев. Из верхнего слоя этилацетата пипеткой отбирают 8—9 мл и переносят в чистую виалу (следить за тем, чтобы конец пипетки не касался нижнего слоя! Использовать каждый раз чистые пипетки!).
К отобранной порции этилацетата добавляют 2 мл реактива Л (п. 2.3.2.2), закрывают виалу крышкой, встряхивают 20 е и оставляют на 5 мин. Из верхнего слоя отбирают 6—7 мл этилацетата, переносят в чистую виалу, добавляют 2 мл реактива Л, встряхивают 30 е и осл авляют на 5 мин. Затем отбирают из верхнего слоя 5 мл этилацетата и переносят в концентратор емкостью 100 мл. Этилацетат в концентраторе упаривают досуха па ротационном вакуумном испарителе при температуре 50 °С.
При гидролизе Мсзотриона получают 4-(метилсульфонил)-2-ни гробензойную кислоту - MNBA.
Гидролиз проб, содержащих Мезотрион, проводится аналогичным образом.
2.3.3.2. Метилирование стандартных растворов и проб.
Для получения метилового эфира MNBA (MNBA-Me) к сухому остатку в концентраторе добавляю! 2 мл раствора диазометана в диэти-ловом эфире, плотно закрывают концентратор, перемешивают содержимое, обмывая стенки концентратора, и оставляют при комнатной температуре на 30 мин. Но окончании метилирования эфир из концен-тратора удаляют током воздуха или азота. Сухой остаток в концентраторе разводят в 5 мл толуола.
Метилирование проб, содержащих MNBA, проводится аналогичным образом.
МУК 4.1.1393—03
2.3.4. Построение калибровочного графика
Для построения калибровочного графика вводят в хроматограф последовательно по 1 мкл каждого из полученных четырех растворов (для каждой концентрации делают нс менее 3 вводов) и измеряют высоту или площадь пиков. Но полученным данным рассчитывают среднее значение высоты пика или его площади для каждой концентрации и строят график зависимости высоты пика или его площади от концентрации Мезотриона в мкг/мл.
2.4. Отбор проб
Отбор проб производится в соответствии с «Унифицированными правилами отбора проб сельскохозяйственной продукции, пищевых продуктов и объектов окружающей среды для определения микроколичеств пестицидов» (№ 2051—79 от 21.08.79).
Пробы воды и почвы хранятся в холодильнике в закрытых бутылках и запаянных пластиковых пакетах соответственно; пробы зеленой массы кукурузы хранятся в запаянных пластиковых пакетах в замороженном виде при температуре - 18 °С. Пробы зерна кукурузы подсушивают до стандартной влажности и хранят в закрытой стеклянной или полиэтиленовой таре при комнатной температуре.
Почву растирают в ступке и просеивают черед сито с размером отверстий 3 мм. Зерно измельчают на лабораторной мельнице, зеленую массу измельчают ножницами.
2.5. Описание определения
2.5.1. Вода
Отбирают 200 мл анализируемой пробы воды в стакан объемом 250 мл, подкисляют ее концентрированной хлороводородной кислотой до pH = 2 при интенсивном перемешивании стеклянной палочкой или на механической мешалке и переливают пробу в делительную воронку емкостью 500 мл. Добавляют в воронку 5 I хлорида натрия, 50 мл этилацетата и встряхивают содержимое воронки в течение 1—2 мин. После разделения слоев нижний водный слой сливают в стакан емкостью 250 мл, а этил ацетат собирают в концентратор, пропуская его через безводный сульфат натрия. Водную фазу возвращают в делительную воронку и повторяют экстракцию еще два раза порциями этилацетата но 30 мл. Объединенные в концентраторе порции эти-
лацетата выпаривают досуха на ротационном вакуумном испарителе при температуре 50 °С.
Сухой остаток растворяют в 1—2 мл ацетона, тщательно обмывают стенки концентратора и переносят раствор Пастеровской пинеткой в виалу. Концентратор ополаскивают небольшими порциями ацетона еще 2 раза, собирая ацетон в ту же виалу. Из виалы ацетон удаляют током теплого воздуха.
После этого сухой остаток заливают 2 мл реактива Джонса (п. 2.3.2.1), плотно закрывают крышками и проводят гидролиз пробы, как указано в п. 2.3.3.1 и ее метилирование, как указано в и. 2.3.3.2.
Но окончании метилирования эфир из концентратора удаляют током воздуха или азота. Сухой остаток в концентраторе разводят в 10 мл толуола. В хроматограф вводят 1 мкл пробы.
2.5.2. Почва
2.5.2.1. Экстракция. Навеску почвы 25 г помещают в пластиковую банку емкостью 250 мл, заливают 50 мл смеси ацетонитрил : вода -1:1 и экстрагируют Мезотрион в течение 30 мин на встряхивателе. По окончании встряхивания пробу центрифугируют 10 мин со скоростью 2000 об/мин. Экстракт фильтруют через бумажный фильтр в концентратор емкостью 250 мл. Экстракцию повторяют еще раз, используя 50 мл экстрагирующей смеси и встряхивая пробу в течение 30 мин, центрифугируют и отфильтровывают экстракт в тот же концентратор. Объединенный экстракт упаривают до водного остатка на ротационном вакуумном испарителе при температуре не выше 40 °С.
2.5.2.2. Очистка экс факта, гидролиз и метилирование. К водному остатку в концентраторе добавляют 10 мл 5 %-ного бикарбоната натрия, подщелачивая раствор до pH = 8, перемешивают содержимое и перенося! в делительную воронку емкостью 250 мл. Концентратор обмывают 50 мл воды и сливают ее в ту же делительную воронку. К содержимому воронки добавляют 50 мл дистиллированной воды, 5 г хлорида натрия и 20 мл диэтилового эфира. Встряхивают воронку в течение 30 с, промывая водную фазу эфиром. После разделения фаз нижнюю водную фазу сливают в стакан емкостью 250 мл, а эфир отбрасывают. Водную фазу возвращают в делительную воронку и промывают 20 мл эфира еще раз. Эфирную фракцию отбрасывают.
*Г1ри необходимости, анализ можно прервать на данном этапе. Концентраторы или виалы закрывают пробками и оставляют до следующего дня в холодильнике.