ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
|
|
НАЦИОНАЛЬНЫЙ
стандарт
РОССИЙСКОЙ
ФЕДЕРАЦИИ
|
ГОСТ Р
54881-
2011
(GHTF/SG4/N33R16:2007)
|
РУКОВОДСТВО ПО АУДИТУ
СИСТЕМ МЕНЕДЖМЕНТА КАЧЕСТВА
ИЗГОТОВИТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ
НА СООТВЕТСТВИЕ РЕГУЛИРУЮЩИМ
ТРЕБОВАНИЯМ
Часть 3
Отчет о проведении аудита
GHTF/SG4/N33R16:2007
Guidelines for regulatory auditing of quality management systems
of medical device manufacturers -
Part 3: Regulatory audit reports
(MOD)
|
|
Москва
Стандартинформ
2012
|
Предисловие
Цели и принципы стандартизации в
Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а
правила применения национальных стандартов Российской Федерации - ГОСТ Р
1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Закрытым
акционерным обществом «МЕДИТЕСТ» на основе собственного аутентичного перевода
на русский язык документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по
стандартизации ТК 436 «Управление качеством медицинских изделий»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ
Приказом Федерального агентства по техническому регулированию и метрологии от
13 декабря 2011 г. № 1188-ст
4 Настоящий стандарт является
модифицированным по отношению к руководящему документу Целевой группы по
глобальной гармонизации (Global Harmonization Task Force
- GHTF) «Руководство по аудиту систем менеджмента
качества изготовителей медицинских изделий на соответствие регулирующим
требованиям. Часть 3. Отчет о проведении аудита» (GHTF/SG4/N33R16:2007
«Guidelines for regulatory auditing of quality management
systems of medical device manufacturers - Part
3: Regulatory audit reports») путем изменения его
структуры, а также путем изменения содержания отдельных структурных элементов
(терминологических статей 3.1, 3.2), которые выделены вертикальной линией,
расположенной слева от текста. При этом исключены разделы 3 «Цель» и 4 «Обоснование» примененного
оригинального документа, которые нецелесообразно применять в национальном
стандарте в связи с требованиями к структуре национального стандарта Российской
Федерации, установленными в ГОСТ Р
1.0-2004, а также в связи с тем, что содержание данных разделов дублируется
содержанием введения и раздела 1
«Область применения». Сравнение структуры настоящего стандарта со структурой
указанного оригинального документа приведено в дополнительном приложении ДА.
Оригинальный текст аутентичного перевода измененных
структурных элементов примененного документа GHTF и
объяснение причин внесения технических отклонений приведены в дополнительном
приложении ДБ.
При применении настоящего стандарта рекомендуется
использовать вместо ссылочных международных стандартов соответствующие им
национальные стандарты Российской Федерации, сведения о которых приведены в
дополнительном приложении ДВ
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту
публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты»,
а текст изменений и поправок - в ежемесячно издаваемых
информационных указателях «Национальные стандарты». В случае пересмотра
(замены) или отмены настоящего стандарта соответствующее уведомление будет
опубликовано в ежемесячно издаваемом информационном указателе «Национальные
стандарты». Соответствующая информация, уведомление и тексты размещаются также
в информационной системе общего пользования - на официальном сайте
Федерального агентства по техническому регулированию и метрологии в сети Интернет
Содержание
|
1 Область
применения. 4
2
Нормативные ссылки. 4
3 Термины
и определения. 5
4 Цели
отчета о проведении аудита и удовлетворение потребностей пользователя. 6
4.1 Цели
отчета о проведении аудита. 6
4.2
Ориентация на организации, проводящие аудиты, и/или регулирующие органы.. 6
4.3
Ориентация на уполномоченный федеральный орган, осуществляющий надзор за
организациями, проводящими аудиты.. 6
4.4
Ориентация на изготовителя и/или проверяемую организацию.. 6
5 Основное
содержание отчета о проведении аудита на соответствие регулирующим
требованиям.. 7
5.1
Данные, относящиеся к проверяемой организации. 7
5.2
Данные, относящиеся к аудиту. 8
5.3
Информация, полученная в ходе аудита. 8
5.4
Аудиторское заключение. 9
5.5 Дата и
подписи. 9
5.6
Приложения к отчету о проведении аудита. 10
Приложение
ДА (обязательное) Сравнение структуры настоящего
стандарта со структурой документа GHTF/SG4/N33R16:2007
«Руководство по аудиту систем менеджмента качества изготовителей медицинских
изделий на соответствие регулирующим требованиям. Часть 3. Отчет о проведении
аудита». 10
Приложение
ДБ (обязательное) Текст измененных структурных
элементов настоящего стандарта и документа GHTF/SG4/N33R16:2007
«Руководство по аудиту систем менеджмента качества изготовителей медицинских
изделий на соответствие регулирующим требованиям. Часть 3. Отчет о проведении
аудита». 10
Приложение
ДВ (справочное) Сведения о соответствии ссылочных
национальных стандартов Российской Федерации международным стандартам,
использованным в качестве ссылочных в примененном документе. 11
|
Введение
Документ «Руководство по аудиту систем менеджмента качества
изготовителей медицинских изделий на соответствие регулирующим требованиям.
Часть 3. Отчет о проведении аудита» разработан исследовательской группой 4 (SG4) «Проведение аудитов на соответствие регулирующим
требованиям» Целевой группы по глобальной гармонизации (GHTF)
- добровольным сообществом, состоящим из представителей регулирующих органов
медицинской промышленности.
Настоящий стандарт является руководством по составлению
отчета о проведении аудита для регулирующих органов, а также организаций и
аудиторов, проводящих аудиты систем менеджмента качества изготовителей
медицинских изделий. В то же время такой отчет может помочь проверяемой
организации понять наблюдения аудита и правильно отреагировать на них.
Примечание - В контексте
настоящего стандарта «аудит» означает «аудит на соответствие регулирующим
требованиям».
Применение настоящего стандарта обеспечивает следующие
преимущества регулирующим органам и организациям, проводящим аудиты:
- достижение большей степени согласованности в отчетах о
проведении аудита как между аудиторами внутри одной организации, проводящей
аудиты, так и между разными организациями, проводящими аудиты;
- достижение более продуктивного сотрудничества между
регулирующими органами/организациями, проводящими аудиты, в отношении аудитов
на соответствие регулирующим требованиям;
- увеличение доверия к аудитам, осуществляемым организацией,
проводящей аудиты, и признание результатов данных аудитов другими регулирующими
органами;
- экономию ресурсов;
- предоставление руководящих указаний для стран, развивающих
системы регулирования для медицинских изделий.
Применение настоящего стандарта обеспечивает следующие
преимущества изготовителям медицинских изделий:
- улучшение обмена информацией, ведущее к улучшению систем
менеджмента качества, а также к улучшению качества и безопасности продукции;
- большую согласованность в отчетах о проведении аудитов;
- сокращение числа аудитов, проводимых у одного
изготовителя;
- экономию ресурсов;
- увеличение доверия к отчетам о проведении аудитов и
признание данных отчетов.
ГОСТ Р 54881-2011
(GHTF/SG4/N33R16:2007)
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
РУКОВОДСТВО ПО АУДИТУ
СИСТЕМ МЕНЕДЖМЕНТА КАЧЕСТВА
ИЗГОТОВИТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ
НА СООТВЕТСТВИЕ РЕГУЛИРУЮЩИМ ТРЕБОВАНИЯМ
Часть 3
Отчет о проведении аудита
Guidelines for auditing of quality
management systems of medical device manufacturers to conform to regulating
requirements. Part 3. Audit report
Дата
введения - 2013-01-01
1 Область применения
Настоящий стандарт является руководством для регулирующих
органов и организаций, проводящих аудиты, по составлению отчета о проведении
аудита системы менеджмента качества изготовителя медицинских изделий на предмет
соответствия данной системы регулирующим требованиям. Такой аудит должен быть
основан на процессном подходе к требованиям к системам менеджмента качества
(см. ГОСТ
Р ИСО 13485). Подробное описание процессного подхода приведено в ГОСТ
Р 54882.
Может возникнуть необходимость в обращении к дополнительным
регулирующим требованиям для удовлетворения потребностей уполномоченного
федерального органа, принимающего отчеты о проведении аудитов и работающего с
ними.
Степень детализации отчета о проведении аудита может быть
различной в зависимости от его возможного использования. Настоящий стандарт
содержит описание отчета, который может быть предоставлен в регулирующие
организации или организации, проводящие аудиты, с которыми организация,
проводящая аудиты, имеет официальное соглашение относительно
конфиденциальности.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на
следующие стандарты:
ГОСТ
Р 54421-2011 Руководство по аудиту систем менеджмента качества
изготовителей медицинских изделий на соответствие регулирующим требованиям. Часть
1. Общие требования
ГОСТ
Р 54882-2011 Руководство по аудиту систем менеджмента качества
изготовителей медицинских изделий на соответствие регулирующим требованиям.
Часть 2. Стратегия аудита
ГОСТ Р ИСО
9000-2008 Системы менеджмента качества. Основные положения и словарь
ГОСТ
Р ИСО 13485-2004 Изделия медицинские. Системы менеджмента качества.
Системные требования для целей регулирования
ГОСТ
Р ИСО 19011-2003 Руководящие указания по аудиту систем менеджмента качества
и/ или систем экологического менеджмента
ГОСТ
Р ИСО/ТС 19218-2008 Изделия
медицинские. Структура кодов видов и причин неблагоприятных событий
Примечание - При
пользовании настоящим стандартом целесообразно проверить действие ссылочных
стандартов в информационной системе общего пользования - на официальном
сайте Федерального агентства по техническому регулированию и метрологии в сети
Интернет или по ежегодно издаваемому информационному указателю «Национальные
стандарты», который опубликован по состоянию на 1 января текущего года, и по
соответствующим ежемесячно издаваемым информационным указателям, опубликованным
в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании
настоящим стандартом следует руководствоваться заменяющим (измененным)
стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором
дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с
соответствующими определениями:
3.1 неблагоприятное
событие (adverse event): Событие, связанное с
применением медицинского изделия и приводящее к смерти или тяжелому поражению
здоровья пациента, пользователя или третьего лица или могущее при его
повторении привести к смерти или тяжелому поражению здоровья пациента,
пользователя или третьего лица (заимствовано из ГОСТ
Р ИСО/ТС 19218).
3.2 наблюдения
(выводы) аудита (audit findings): Результаты
оценивания собранных свидетельств аудита на соответствие критериям аудита
(заимствовано из ГОСТ Р
ИСО 9000; пункт 3.9.5).
Примечание
- Наблюдения аудита могут указывать на соответствие или несоответствие
критериям аудита или на возможности улучшения.
3.3 соблюдение/соответствие (compliance/conformity): Выполнение регулирующих требований.
Примечание - В настоящем
стандарте термины «соблюдение» и «соответствие» используются как
взаимозаменяемые, хотя в некоторых юрисдикциях они могут различаться и иметь
разные значения.
3.4 значимый поставщик (critical
supplier): Поставщик материалов, компонентов или услуг, которые могут
повлиять на безопасность и функционирование продукции.
3.5 уполномоченный федеральный орган (designating authority): Орган, учрежденный или уполномоченный
правительством для назначения организаций, проводящих аудиты, временного
прекращения их полномочий, аннулирования их назначения или устранения
упомянутого временного прекращения полномочий.
3.6 несоответствие (nonconformity):
Невыполнение требования (заимствовано из ГОСТ Р ИСО
9000; пункт 3.6.2).
Примечание - Объяснение термина «несоответствие» приведено в
ГОСТ
Р 54421.
3.7 аудит на соответствие регулирующим требованиям (regulatory audit): Аудит системы менеджмента качества с целью
демонстрации ее соответствия регулирующим требованиям (заимствовано из ГОСТ
Р 54882).
3.8 отчет о проведении аудита на соответствие
регулирующим требованиям (regulatory auidit report):
Документ или совокупность документов, составленных аудиторской группой и
содержащих административную информацию, а также краткую информацию об объектах,
функциях и процессах, подвергшихся аудиту, наблюдениях и заключениях аудита.
Примечание - В настоящем
стандарте «отчет о проведении аудита» означает «отчет о проведении аудита на
соответствие регулирующим требованиям».
3.9 регулирующие требования (regulatory
requirements): Часть закона, постановления, указа или другого
регулирующего документа, распространяющегося на изготовителей медицинских
изделий.
Примечания
1 Рекомендации, проекты
документов и т. п. не рекомендуется использовать в качестве регулирующих
документов и истолковывать как таковые, даже если они будут официально
опубликованы (ГОСТ
Р 54421).
2 В настоящем стандарте
регулирующие требования ограничены теми требованиями, которые относятся к системам
менеджмента качества.
4 Цели отчета о проведении
аудита и удовлетворение потребностей пользователя
4.1 Цели отчета о проведении аудита
Отчет о проведении аудита содержит документированное
свидетельство проведения аудита на соответствие регулирующим требованиям.
Имеющаяся в нем информация должна быть достаточной:
- для документирования области аудита, вида аудита, его
целей, критериев, объектов аудита, наблюдений аудита;
- оценивания степени соответствия проверяемой организации,
результативности внедренной системы менеджмента качества и заключений по
результатам аудита;
- возможности обмена отчетами о проведении аудитов между
регулирующими органами и/или организациями, проводящими аудиты.
4.2 Ориентация на организации, проводящие аудиты,
и/или регулирующие органы
Организации, проводящие аудиты, и/или регулирующие органы
могут использовать отчеты о проведении аудитов:
- для обеспечения записей по проверяемым видам деятельности;
- оценивания соответствия проверяемой организации
регулирующим требованиям;
- оценивания соответствия системы менеджмента качества
критериям аудита;
- обеспечения свидетельства для принятия решения о
соответствии регулирующим требованиям;
- подготовки к следующему аудиту;
- ведения истории аудита;
- определения тенденции истории соответствия для проверяемой
организации;
- определения тенденции истории соответствия для конкретной
отрасли промышленности;
- надзора за отчетами о неблагоприятных событиях;
- обмена информацией между организациями, проводящими
аудиты, и/или регулирующими органами;
- оценивания деятельности аудитора(ов);
- улучшения согласованности между аудиторами.
4.3 Ориентация на уполномоченный федеральный орган,
осуществляющий надзор за организациями, проводящими аудиты
Уполномоченный федеральный орган, осуществляющий контроль и
надзор за организациями, проводящими аудиты, использует отчеты о проведении
аудитов:
- для оценивания компетентности организации, проводящей
аудиты, и входящих в нее аудиторов;
- надзора за деятельностью организаций, проводящих аудиты, и
входящих в них аудиторов;
- улучшения согласованности между различными организациями,
проводящими аудиты, и входящими в них аудиторами.
4.4 Ориентация на изготовителя и/или проверяемую
организацию
Изготовитель и/или проверяемая организация используют отчеты
о проведении аудитов:
- для обеспечения записей по проверяемым видам деятельности
и области аудита;
- обеспечения свидетельства соответствия регулирующим
требованиям;
- определения статуса системы менеджмента качества (включая несоответствия);
- осуществления обратной связи с целью дальнейшего улучшения
системы менеджмента качества;
- подготовки к следующему аудиту;
- ведения истории аудита;
- определения тенденции соответствия;
- обеспечения свидетельства соответствия для регулирующих
органов/организаций, проводящих аудиты, как часть деятельности по
регистрации/лицензированию продукции;
- выполнения необходимых корректирующих и предупреждающих
действий.
5 Основное содержание отчета
о проведении аудита на соответствие регулирующим требованиям
Организация, проводящая аудиты, или регулирующий орган могут
выбрать те процедуры отчетности, которые отвечают их потребностям. Основное
содержание отчета по аудиту, приведенное в данном разделе, рекомендуется в
качестве минимально необходимого требования.
Отчет должен быть представлен в печатном виде в формате,
пригодном для его хранения и передачи электронными средствами. В отчете следует
идентифицировать информацию, являющуюся коммерческой тайной и собственностью
организации, для обеспечения конфиденциальности. В подразделах 5.1 -
5.6
настоящего стандарта приведено описание рекомендуемого содержания отчета о
проведении аудита в рекомендуемом порядке.
Примечание - Язык отчета
о проведении аудита рекомендуется согласовать между проверяемой организацией и
организацией, проводящей аудит, заранее, до начала аудита. Во многих случаях
выбор языка определяется конечным пользователем отчета.
5.1 Данные, относящиеся к
проверяемой организации
5.1.1 Наименование проверяемой организации, адрес, телефон,
факс, электронный адрес.
5.1.2 Идентификационный или регистрационный номер
организации для каждого регулирующего органа, задействованного в аудите (когда
применимо).
5.1.3 Описание проверяемой организации (приблизительное
число сотрудников, охватываемых областью аудита; штатное расписание; часы
работы, рабочие смены и любые сезонные изменения; наименование(ия) изделия(й);
количество экспортируемых изделий, выраженное в штуках или в процентах, с
указанием стран, куда изделия экспортируются). Если помимо главной
производственной площадки в проверяемой организации имеются другие площадки и
они также подлежат аудиту, то рекомендуется указать на взаимосвязь,
существующую между этими объектами.
5.1.4 Логотип (товарный знак) организации-изготовителя и ее
наименование (в том числе сокращенное).
5.1.5 Статус всех сертификатов, свидетельств, аттестаций,
имеющих отношение к области аудита.
5.1.6 Область применения/ассортимент продукции, выпускаемой
организацией, и категории изделий, охватываемых аудитом (с использованием
применимой номенклатурной системы, например Международной номенклатуры
медицинских изделий - Global Medical Device Nomenclature,
GMDN, если осуществимо).
5.1.7 Наименование, местонахождение и виды деятельности
значимых поставщиков, если таковые имеются.
5.1.8 Информация о представителе высшего
руководства, ответственном за систему менеджмента качества.
5.1.9 Сведения о предыдущем аудите, включая дату,
наименование организации, проводившей аудит, фамилии, имена, отчества
аудиторов, критерии аудита, подсистемы, подвергшиеся аудиту, и результаты
аудита, когда применимо.
5.1.10 Дополнительная информация касательно истории
соответствия проверяемой организации регулирующим требованиям, если таковая
имеется.
5.1.11 Информация о представителе проверяемой организации
или другом(их) лице(ах) (если он не является лицом, указанным в 5.1.8),
ответственном:
- за организацию проведения аудита;
- получение отчета о проведении аудита;
- получение документа о соответствии регулирующим
требованиям.
5.1.12 Рабочий(е) язык(и).
5.1.13 Исключение и неприменение требований к системе
менеджмента качества.
5.2 Данные, относящиеся к аудиту
5.2.1 Вид аудита (первоначальный, подтверждающий,
специальный).
5.2.2 Область аудита, его цели и критерии, в соответствии с
которыми был проведен аудит (регулирующие документы и стандарты).
5.2.3 Даты и время проведения аудита в организации.
5.2.4 Общее время, затраченное на аудит (в человеко-днях).
5.2.5 Идентификация организации, проводившей аудит, и членов
группы по аудиту (включая технических экспертов), распределение полномочий и
ответственности.
5.2.6 Язык(и) аудита.
5.2.7 Сведения о переводчике(ах), если таковые имеются.
5.2.8 Наблюдатель(и) и наименование организации, к которой
он (они) относятся, если таковые имеются.
5.2.9 Перечень документов, проанализированных до начала
аудита, включая идентификацию этих документов и статус их пересмотра.
5.3 Информация, полученная в ходе аудита
5.3.1 Описание видов деятельности, охваченных аудитом.
Необходимо составить краткое описание основных элементов каждой из подсистем,
подвергшихся аудиту:
- высшее руководство;
- проектирование и разработка [описание
проанализированного(ых) проекта(ов)];
- документация на продукцию;
- управление продукцией и процессами [описание
проанализированных продукции и процесса(ов)];
- корректирующие и предупреждающие действия (какие источники
данных доступны для анализа и какие из них были проанализированы);
- управление закупками;
- управление документацией и записями;
- процессы, связанные с потребителем.
Примечание -
Вышеуказанные подсистемы приведены в ГОСТ
Р 54882.
Краткое описание подсистемы должно включать в себя:
- назначение осмотренных объектов (например, входной
контроль, производственные помещения, лаборатории контроля качества и т. д.) и,
при необходимости, сведения об опрошенных сотрудниках;
- виды деятельности и процессы, подвергшиеся аудиту, включая
причины их выбора;
- проанализированные документы, включая их число, сведения о
пересмотре и т. д.;
- ссылки на проанализированные записи, например, жалобы
потребителей, записи о партиях изделий и т. д.;
- ссылки на проанализированные изделия, например, технологические
процессы, комплектующие и т. д.
Подтверждение соответствия стандарту или регулирующему
документу после проведения аудита, например:
- соответствие;
- комментарии относительно возможностей улучшения, при
необходимости;
- несоответствие (включая значительные несоответствия).
Примечание - Если
комментарии о необходимости улучшения записаны в отчете о проведении аудита,
включающем в себя сведения о невыполнении требований, не приводящем, однако, к
несоответствию системы менеджмента качества, то следует пояснить, почему в
данном случае не было принято решение о несоответствии.
Если для демонстрации полноты охвата конкретной области
использован типовой контрольный перечень, не содержащий какой-либо
дополнительной информации, то рекомендуется отразить этот факт в письменном
отчете.
5.3.2 Описание причин возврата изделий, корректирующих
действий, относящихся к соблюдению требований безопасности в конкретной
области, а также описание утилизации или замены изделий со времени предыдущего
аудита, если таковые имелись.
5.3.3 Описание существенных изменений, произошедших со
времени предыдущего аудита в изделиях или процессах, в организационной
структуре, структуре собственности, руководящем составе (ведущих специалистах)
и в системе менеджмента качества.
5.3.4 Описание всех последующих действий, выполненных
проверяемой организацией по конкретным жалобам или отчетам о неблагоприятных
событиях.
5.3.5 Идентификация затребованной информации, в получении
которой было отказано, и всех возникших препятствий, ставящих под угрозу
объективность наблюдений и заключений аудита.
5.3.6 Идентификация несоответствий, в том числе:
- подробная информация о каждом несоответствии;
- критерий(ии) аудита или конкретное регулирующее
требование, к которым относится несоответствие;
- относительная значимость сточки зрения регулирующих
требований;
- дата представления запланированных корректирующих
действий.
5.3.7 Подробная информация о корректирующих действиях,
предпринятых в процессе аудита.
Примечание - При обнаружении
несоответствия рекомендуется сделать соответствующую запись, даже если
проверяемая организация устранила несоответствие в ходе аудита.
5.3.8 Верификация результативного выполнения корректирующих
действий со времени предыдущего аудита.
5.3.9 Описание всех проблем, нуждающихся в решении, но не
вошедших в перечень несоответствий (если таковые имеются), или комментарии в
отношении необходимых улучшений.
5.3.10 Период времени, установленный для устранения
несоответствий, если таковые имеются.
5.3.11 Вопросы, которые необходимо рассмотреть при
последующем аудите.
5.3.12 Подробная информация, предоставленная на
заключительном совещании, в том числе реакция проверяемой организации.
5.3.13 Неразрешенное расхождение во мнениях между
аудиторской группой и проверяемой организацией.
5.3.14 Любые области, не подвергшиеся аудиту, но входящие в
область аудита.
5.4 Аудиторское заключение
5.4.1 Краткое содержание и выводы о соответствии системы
менеджмента качества проверяемой организации по каждой группе критериев аудита.
5.4.2 Краткое содержание и выводы касательно
результативности системы менеджмента качества в достижении целей в области
качества.
5.4.3 Рекомендации аудиторов для проверяемой организации
(при необходимости):
- последующие действия, включая предложенный график
выполнения данных действий;
- рекомендации касательно первоначальной сертификации или
ресертификации.
5.4.4 Подтверждение того, что цели аудита достигнуты или, в
противном случае, объяснение того, почему они не достигнуты.
5.5 Дата и подписи
5.5.1 Датирование отчета о проведении аудита.
5.5.2 Фамилии, имена, отчества аудиторов, их должности и
наименование организаций, в которых они работают (подписи или печати аудиторов
на отчете).
5.6 Приложения к отчету о
проведении аудита
План(ы) аудита (при необходимости).
Список присутствующих на первоначальном и заключительном
совещаниях (при необходимости).
Документы, затребованные организацией, проводившей аудит.
Свидетельства, подтверждающие наличие выявленных несоответствий. Контрольные
листы, используемые аудиторами. Отчет о несоответствиях, если таковой издается
отдельно.
Приложение ДА
(обязательное)
Сравнение структуры настоящего стандарта со структурой
документа GHTF/SG4/N33R16:2007
«Руководство по аудиту систем менеджмента качества изготовителей медицинских
изделий
на соответствие регулирующим требованиям. Часть 3. Отчет о проведении аудита»
Таблица
ДА.1
|
Номер раздела настоящего стандарта
|
Номер документа GHTF
|
|
0 Введение
|
1.0 Введение
|
|
1
Область применения
|
2.0 Область применения
|
|
-
|
3.0 Цель
|
|
-
|
4.0 Обоснование
|
|
2
Нормативные ссылки
|
5.0 Нормативные ссылки
|
|
3
Термины и определения
|
6.0 Определения
|
|
4
Цели отчета о проведении аудита и удовлетворение потребностей пользователя
|
7.0 Цели отчета о
проведении аудита и удовлетворение потребностей пользователя
|
|
5
Основное содержание отчета о проведении аудита на соответствие регулирующим
требованиям
|
8.0 Основное содержание
отчета о проведении аудита на соответствие регулирующим требованиям
|
|
Примечание - Приложения
настоящего стандарта соответствуют приложениям документа GHTF.
|
Приложение ДБ
(обязательное)
Текст измененных структурных элементов настоящего
стандарта и документа GHTF/SG4/
N33R16:2007
«Руководство по аудиту систем менеджмента качества изготовителей
медицинских изделий на соответствие регулирующим требованиям.
Часть 3. Отчет о проведении аудита»
I Текст разделов 3.0 и 4.0,
исключенных из документа GHTF/SG4/N33R16:2007 «Руководство по аудиту
систем менеджмента качества изготовителей медицинских изделий на соответствие
регулирующим требованиям. Часть 3. Отчет о проведении аудита», так как
нецелесообразно включать данные разделы в национальный стандарт в связи с
требованиями к структуре национального стандарта Российской Федерации,
установленными в ГОСТ Р
1.0-2004, а также в связи с тем, что содержание данных разделов дублируется
содержанием введения и раздела 1 «Область применения» настоящего стандарта.
3.0 Цель
Целью настоящего документа является способствование согласованности
основного содержания отчета о проведении аудита для обеспечения руководства
организации наилучшей практикой.
4.0 Обоснование
Настоящий документ позволяет обеспечить согласованность отчетов
о проведении аудитов, что важно для достижения согласия и взаимного признания
результатов аудитов.
В отчете о проведении аудита рекомендуется
продемонстрировать, что был проведен аудит на соответствие системы менеджмента
качества регулирующим требованиям и что данный аудит был достаточно глубоким и
всесторонним.
Настоящий документ обеспечивает пользователя структурой
отчета о проведении аудита, применимой в различных юрисдикциях, что
способствует достижению согласованности и единообразия и помогает аудитору
подготовить отчет, который может быть использован разными регулирующими
органами и/или организациями, проводящими аудиты. Наличие отчетов, однотипных
по содержанию, облегчает анализ и обмен отчетами о проведении аудитов.
Признание отчетов о проведении аудитов разными регулирующими органами должно, в
итоге, способствовать сокращению числа аудитов, проводимых у изготовителей.
Настоящий документ можно также использовать для
подтверждения двусторонних и многосторонних соглашений.
II Оригинальный текст измененных
терминологических статей документа GHTF/SG4/N33R16:2007
«Руководство по аудиту систем менеджмента качества изготовителей медицинских
изделий на соответствие регулирующим требованиям. Часть 3. Отчет о проведении
аудита»
Терминологические статьи 3.1 и 3.2 изменены в связи с наличием
в Российской Федерации гармонизированных стандартов, в которых данные термины
стандартизованы. Текст терминологической статьи 3.1 приведен в соответствие с
текстом ГОСТ
Р ИСО/ТС 19218. Соответственно ссылка изменена на ГОСТ
Р ИСО/ТС 19218. Текст терминологической статьи 3.2 приведен в соответствие с ГОСТ Р ИСО
9000. Соответственно ссылка изменена на ГОСТ Р ИСО
9000.
3.1 неблагоприятное событие (adverse
event): Несрабатывание (неправильное срабатывание) или ухудшение
характеристик или функционирования проданного медицинского изделия (включая
принадлежности и маркирование), или ошибка эксплуатации, являющиеся причиной
или могущие стать причиной, или способствующие смерти или тяжелому поражению
здоровья пациентов или других лиц (заимствовано из GHTF/SG2/N36R7).
3.2 наблюдения аудита (audit
findings): Результаты оценивания полученного свидетельства аудита в
зависимости от критериев аудита (заимствовано из ИСО 19011).
Примечание - Наблюдения
аудита могут соответствовать или не соответствовать критериям аудита или
возможностям улучшения деятельности организации.
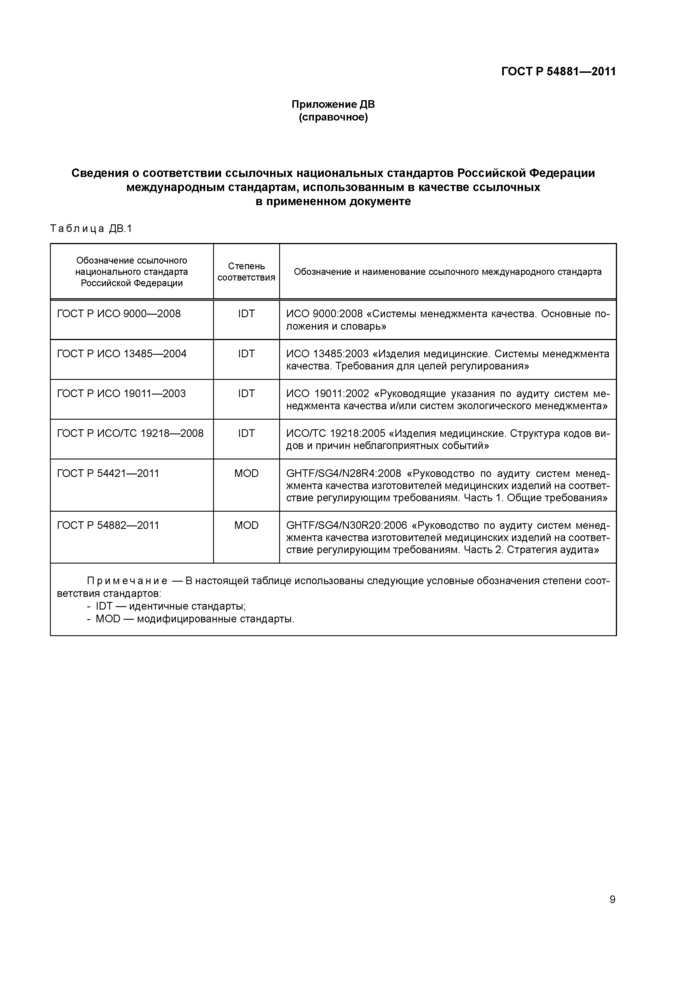
Приложение ДВ
(справочное)
Сведения о соответствии ссылочных национальных
стандартов Российской Федерации
международным стандартам, использованным в качестве ссылочных
в примененном документе
Таблица
ДВ.1
|
Обозначение ссылочного
национального стандарта
Российской Федерации
|
Степень соответствия
|
Обозначение и наименование ссылочного международного
стандарта
|
|
ГОСТ Р ИСО
9000-2008
|
IDT
|
ИСО
9000:2008 «Системы менеджмента качества. Основные положения и словарь»
|
|
ГОСТ
Р ИСО 13485-2004
|
IDT
|
ИСО
13485:2003 «Изделия медицинские. Системы менеджмента качества. Требования для
целей регулирования»
|
|
ГОСТ
Р ИСО 19011-2003
|
IDT
|
ИСО
19011:2002 «Руководящие указания по аудиту систем менеджмента качества и/или
систем экологического менеджмента»
|
|
ГОСТ
Р ИСО/ТС 19218-2008
|
IDT
|
ИСО/TС
19218:2005 «Изделия медицинские. Структура кодов видов и причин
неблагоприятных событий»
|
|
ГОСТ
Р 54421-2011
|
MOD
|
GHTF/SG4/N28R4:2008
«Руководство по аудиту систем менеджмента качества изготовителей медицинских
изделий на соответствие регулирующим требованиям. Часть 1. Общие требования»
|
|
ГОСТ
Р 54882-2011
|
MOD
|
GHTF/SG4/N30R20:2006
«Руководство по аудиту систем менеджмента качества изготовителей медицинских
изделий на соответствие регулирующим требованиям. Часть 2. Стратегия аудита»
|
|
Примечание - В
настоящей таблице использованы следующие условные обозначения степени
соответствия стандартов:
- IDT -
идентичные стандарты;
- MOD -
модифицированные стандарты.
|
Ключевые слова:
аудит на соответствие регулирующим требованиям, система менеджмента качества,
изготовитель, медицинское изделие, отчет по аудиту