ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
Производство лекарственных средств
ОРГАНИЗАЦИОННО-ТЕХНОЛОГИЧЕСКАЯДОКУМЕНТАЦИЯ
Издание официальное
Москва
Стандартинформ
2007
ГОСТ Р 52550-2006
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.&—2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 РАЗРАБОТАН Общероссийской общественной организацией «Ассоциация инженеров по контролю микрозагрязнений» (АСИНКОМ)
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 458 «Правила производства и контроля качества лекарственных средств»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 2 июня 2006 г. № 105-ст
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Июнь 2007 г.
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты». а текст изменений и поправок — в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ. 2006 © Стандартинформ. 2007
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
ГОСТ Р 52550-2006
Содержание
1 Область применения...................................................1
2 Нормативные ссылки..................................................1
3 Термины и определения................................................1
4 Общие положения....................................................2
5 Структура организационно-технологической документации..........................3
6 Ведение документации.................................................8
Приложение А (справочное) Пример формы спецификации на материалы.................10
Приложение В (справочное) Пример формы спецификации на промежуточную и готовую продукцию 11 Приложение С (справочное) Виды технологических регламентов по производству лекарственных
средств..................................................12
Приложение D (справочное) Технологические инструкции и инструкции по фасовке и упаковке. ... 15 Приложение Е (справочное) Рекомендуемый перечень инструкций, методик и стандартов предприятия..................................................17
Приложение F (справочное) Пример формы инструкции (методики).....................18
Приложение G (справочное) Примеры форм протоколов производства серии...............19
Приложение Н (справочное) Пример инструкции по упаковке и протоколов упаковки. Инструкция
по упаковке флаконов в индивидуальную тару.........................27
Приложение I (справочное) Примеры внутрипроизводственных этикеток. Этикетка контроля качества ОКК ................................................34
Приложение J (справочное) Пример системы кодирования...........................38
Библиография........................................................39
III
Введение
Обязательными требованиями к производству лекарственных средств являются:
- идентичное, стандартное выполнение всех операций:
- прослеживаемость процесса производства каждой серии продукции:
- обеспечение полного соответствия всех этапов производства, исходных и упаковочных материалов, промежуточной и готовой продукции заданным требованиям.
С этой целью производство лекарственных средств должно основываться на системе документации. регламентирующей организацию и технологию производства, контроль качества и документальное оформление всех выполняемых операций. Любое действие должно выполняться в соответствии с документом. Исключаются следование устным распоряжениям и выполнение действий по собственному усмотрению.
Порядок производства лекарственных средств регламентируется системообразующим стандартом ГОСТ Р 52249. Настоящий стандарт детализирует требования ГОСТ Р 52249 в части ведения организационно-технологической документации.
IV
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Производство лекарственных средств
ОРГАНИЗАЦИОННО-ТЕХНОЛОГИЧЕСКАЯ ДОКУМЕНТАЦИЯ
Manufacturing of medicinal products.
Organizing and technological documentation
Дата введения — 2007—01—01
1 Область применения
Настоящий стандарт устанавливает основные требования к организационно-технологической документации, необходимой для производства лекарственных средств по ГОСТ Р 52249, ее содержанию и порядку ведения.
Стандарт не устанавливает конкретные формы документов, требования к их разработке, согласованию. утверждению, хранению и пр., которые определяются самим предприятием — производителем лекарственных средств (ЛС). Приведенные в приложениях образцы документов носят справочный характер.
Стандарт не распространяется на организационно-распорядительную документацию (приказы, распоряжения, должностные инструкции и пр.).
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ Р 51141-98 Делопроизводство и архивное дело. Термины и определения
ГОСТ Р 52249-2004 Правила производства и контроля качества лекарственных средств
ГОСТ Р 52537-2006 Производство лекарственных средств. Система обеспечения качества. Общие требования
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального атентства по техническому ретулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущею года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный документ заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться замененным (измененным) документом. Если ссылочный документ отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины и определения:
3.1 спецификация (specification): Документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств (ГОСТ Р 52249).
3.2 промышленный регламент, технологическая инструкция и инструкция по упаковке: Документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции (ГОСТ Р 52249).
Издание официальное
Примечания
1 Промышленный регламент охватывает все аспекты технологического процесса, требования к качеству сырья, внутрипроизводственному контролю, контролюкачества. безопасности труда, экологической безопасности, утилизации отходов и пр.
2 Допускается использование термина «технологический регламент» вместо термина «промышленный регламент».
3.3 инструкция, методика, процедура (procedure, standard operation procedure): Документы, содержащие указания по выполнению отдельных видов операций; например, по очистке, переодеванию. контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации и техническому обслуживанию оборудования (ГОСТ Р 52249).
Примечание — «Стандартная операционная процедура — СОП» — нерекомендуемый термин.
3.4 протокол на серию (record): Документ, отражающий ход производства каждой серии продукции. в т. ч. разрешение на ее реализацию и все факторы, влияющие на качество готовой продукции (ГОСТ Р 52249).
Примечание — Протокол на серию продукции (досье на серию) включает:
- протокол(ы)иа производство серии по ГОСТ Р 52249 (подраздел 4.17);
- протокол(ы) на упаковку серии по ГОСТ Р 52249 (подраздел 4.18);
- протоколы контроля исходных и упаковочных материалов, в том числе разрешение на их применение;
- протокол или другой документ по контролю качества готовой продукции;
- разрешение на реализацию серии продукции;
- протоколы на подготовку оборудования, помещений и пр.;
- другие документы (при необходимости).
Данные о проведении основных технологических операций, исполнителях и пр. могут оформляться в виде маршрутных карт.
3.5 учтенные копии: Копии документов, находящиеся на учете в подразделении, контролирующем ведение документации, и в которые вносятся любые изменения для поддержания их соответствия оригиналу.
3.6 серия (batch, or lot): Определенное количество однородных исходных и упаковочных материалов или однородной продукции, обработанной в ходе одной или нескольких последовательных технологических стадий (ГОСТ Р 52249).
Примечание — При необходимости на определенных стадиях производства серия может быть разделена на подсерии, объединяемые впоследствии в однородную серию продукции. При непрерывном производстве понятие серии должно относиться к определенной части продукции, характеризуемой однородностью.
С точки зрения контроля готовой продукции серин продукции включает в себя совокупность единиц дозированной формы лекарственных средств (лекарственной формы), изготовленных из одного обьема исходного материала и прошедших единую последовательность производственных операций или единый цикл стерилизации; при непрерывном производстве — все единицы, произведенные в заданный интервал времени.
3.7 организационно-распорядительный документ Вид письменного документа, в котором фиксируют решение административных и организационных вопросов, а также вопросов управления, взаимодействия, обеспечения и регулирования деятельности органов власти, учреждений, предприятий, организаций, их подразделений и должностных лиц (ГОСТ Р 51141).
4 Общие положения
4.1 Основные требования к документации:
- исчерпывающий характер, т. е. охват всех выполняемых операций, требований к материалам, продукции, методам испытаний и пр.;
- ясно сформулированное наименование и назначение;
- отсутствие лишней информации и ее необоснованного дублирования;
- ясное изложение текста без неопределенности и двусмысленности;
- логичная структура, системное изложение в соответствии с установленным порядком кодирования (рубрикации, нумерации);
- оформление и утверждение в установленном порядке.
4.2 Система документации в производстве лекарственных средств должна соответствовать разрешительной документации и регистрационному досье, требованиям надзорных органов. нормативным и нормативно-правовым документам.
2
ГОСТ Р 52550-2006
4.3 Следует предусмотреть порядок ведения документации в системе обеспечения качества, включая порядок ее использования, учета и системы нумерации, кодирования и маркирования, а также оформления и рассмотрения полученных данных и протоколов на серию готовой продукции (далее — серию). На предприятии должна быть разработана инструкция, регламентирующая порядок ведения документации.
4.4 Ведение документации в соответствии с установленными требованиями обеспечивает постоянную воспроизводимость при производстве серий продукции, предотвращает ошибки, возникающие при устном общении, неправильном толковании слов, неполной или утерянной информации, дает возможность проследить историю серии продукции и при необходимости выявить причины отклонений, влияющие на качество, и внести коррективы во избежание повторения отклонений в будущем.
4.5 Документы, как правило, не должны быть рукописными. Данные, которые вносятся в бланки рукописным способом, должны быть выполнены четким, разборчивым почерком, так, чтобы эти записи нельзя было аннулировать.
4.6 Документы должны систематически рассматриваться на предмет соответствия текущим требованиям с внесением изменений (при необходимости) и пересматриваться по истечении срока ее действия.
Внесение изменений в документы должно выполняться одновременно с изменением технологического процесса. Не допускается отклонение от требований документов, если изменения не оформлены в установленном порядке. Внесение изменений должно выполняться во все учтенные копии.
4.7 При совершенствовании производства следует своевременно пересматривать систему документации (вносить изменения, удалять неиспользуемую информацию и пр.).
4 .8 Технологическая документация должна быть согласована с отделом контроля качества (ОКК). Ее взаимосвязь с документацией по контролю качества обеспечивается путем перекрестных ссылок.
4.9 При необходимости в документах могут быть приведены требования безопасности в виде отдельных пунктов (разделов), относящихся непосредственно к производству данной продукции. По возможности, следует заменять их ссылками на соответствующие документы, которые должны быть проверены и согласованы лицами, ответственными на предприятии за выполнение требований по охране труда и(или) окружающей среды.
4.10 Основой организационно-технологической документации являются законы, технические регламенты. стандарты, фармакопейные статьи и другие нормативные и нормативно-правовые документы.
4.11 Система организационно-технологической документации работает совместно с системой организационно-распорядительной документации по ГОСТ Р 51141. в которую входят устав предприятия. положения о подразделениях, должностные инструкции и пр.
5 Структура организационно-технологической документации
5.1 Виды организационно-технологических документов приведены в таблице 1.
|
Таблица 1 — Виды организационно-технологических документов |
|
Наименование документа |
Назначение |
|
1 Информация о предприятии, регистрационное досье, лицензия на производство и пр. |
Общая документация предприятия |
|
2 Спецификация |
Документ, содержащий требования к материалам или продукции |
|
3 Промышленный регламент, технологическая инструкция, инструкция по упаковке |
Документы, устанавливающие требования к процессам производства конкретной продукции |
|
4 Инструкция (методика) |
Документ, устанавливающий требования, общие для производств различных видов продукции |
|
5 Протокол на серию |
Документ, отражающий фактические данные о производстве конкретной серии продукции |
|
6 Внутрипроизводственная этикетка |
Документ, идентифицирующий материалы или продукцию. содержащие указание их статуса в производстве |
|
|
3 |
На предприятии также должны использоваться методики аттестации критического оборудования и процессов, протоколы аттестации, документы проведения аудитов (самоинспекций) и пр.
5.2 Содержание информации о предприятии и регистрационного досье регламентируются ГОСТ Р 52537.
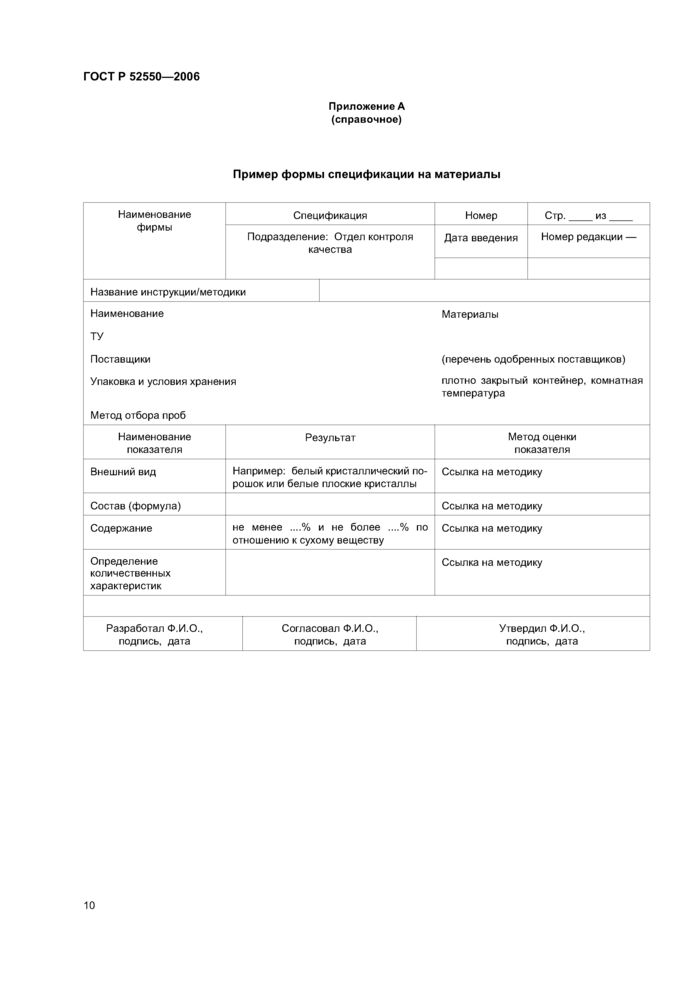
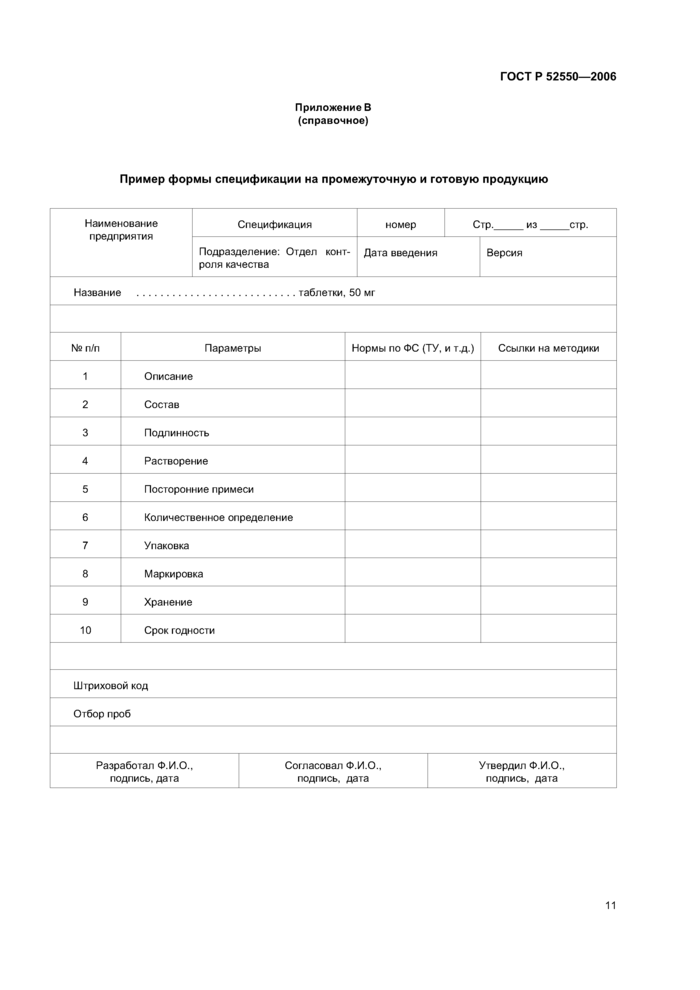
5.3 Спецификации
Спецификации составляются для следующих материалов и продукции:
- исходных, вспомогательных и упаковочных материалов:
- промежуточной продукции (при ее наличии);
- готовой продукции.
В спецификации указываются:
- наименование материала (продукции) со ссылкой на внутренний код предприятия (при необходимости);
- ссылку на фармакопейную статью или другой нормативный документ;
- основные характеристики материала (продукции);
- порядок отбора проб и проведения испытаний (ссылки на методику испытания);
- условия хранения и меры предосторожности (ссылки на инструкцию);
- срок годности (хранения) и периодичность повторных испытаний;
-другие данные.
К спецификации должен прилагаться перечень поставщиков и производителей материалов.
Примечание — К вспомогательным материалам относятся фильтрующие элементы, моющие и дезинфицирующие средства и лр.
Примеры форм спецификаций приведены в приложениях А и В.
5.4 Промышленные регламенты, технологические инструкции и инструкции по упаковке
Данные документы разрабатываются для серийного производства продукции и содержат детальное описание технологического процесса с указанием стадий процесса, выполняемых операций, требований к оборудованию, используемым материалам, методам контроля и пр. (1), (2]. (3). В зависимости от назначения могут также разрабатываться лабораторные, опытно-промышленные и пусковые регламенты. Виды технологических регламентов по производству лекарственных средств приведены в приложении С.
Для каждого размера серии продукции разрабатывается промышленный или иной регламент с технологическими инструкциями, в том числе по фасовке и упаковке, утвержденными в установленном порядке. Требования к технологическим инструкциям приведены в приложении D.
5.5 Инструкции и методики
5.5.1 Общие положения
Инструкции и методики охватывают все сферы производства и контроля качества и регламентируют действия, общие для различных видов продукции. Они не включают требования к производству конкретной продукции, которые изложены в промышленном регламенте (2]. [3], (4). [5]. Инструкции и методики могут оформляться в виде стандарта предприятия.
Инструкции и методики регламентируют:
- получение и контроль качества исходных и упаковочных материалов;
- контроль качества промежуточной и готовой продукции;
- работу лабораторий;
- аттестацию критических процессов и оборудования;
- работу складов, обращение материалов, промежуточной и готовой продукции;
- технологическое и инженерное оборудование (системы отопления, вентиляции и кондиционирования воздуха, подготовки воды. пара, технологических жидкостей и газов, сжатого воздуха, чистые помещения, эксплуатация, техническое обслуживание и ремонт оборудования, калибровка приборов и
т.д.);
- требования к поведению, гигиене и состоянию здоровья персонала;
- порядок ведения документации и т.д.
Персонал должен знать инструкцию и уметь ответить на любой вопрос, касающийся ее. Инструкции не должны содержать лишние данные, не используемые в работе, так как они могут служить причиной признания несоответствия производства требованиям ГОСТ Р 52249.
Инструкции, включая изменения к ним, должны соответствовать требованиям нормативных документов, промышленных регламентов, технической документации на процессы и оборудование.
Инструкции разрабатываются в следующих случаях:
- организации нового производства;
4
ГОСТ Р 52550-2006
- реконструкции производства;
- введения нового оборудования и процессов или внесения в них изменений;
- изменения нормативных документов, требующего разработки новой инструкции. Рекомендуемый перечень инструкций, методик и стандартов предприятия приведен в приложении Е.
5.5.2 Содержание инструкции
Настоящий стандарт устанавливает общие требования к содержанию и форме инструкции. Конкретные требования определяются самим предприятием с учетом того, что инструкция должна носить исчерпывающий характер.
При большом объеме инструкции, например, инструкции по техническому обслуживанию, допускается ссылка на другие документы. В этом случае должен быть организован контроль изменений в документах. на которые сделана ссылка.
Рекомендуется включать в инструкцию следующие разделы:
a) общие данные:
- наименование предприятия;
- наименование подразделения;
- наименование инструкции;
- номер инструкции;
- дата утверждения инструкции;
- дата и номер внесения изменения (при необходимости);
- срок действия инструкции;
- данные по истории инструкции (номер и дату прежнего варианта и номера и даты внесения всех изменений);
b) специальные данные:
- область применения инструкции (при необходимости, указание областей, на которые она не распространяется);
- перечень лиц (должностей, подразделений), на которые распространяется инструкция;
- требования к охране окружающей среды (при необходимости) с указанием мер защиты или со ссылкой на соответствующие документы;
- требования техники безопасности и производственной санитарии с указанием средств индивидуальной защиты;
- перечень документов, связанных с данной инструкцией;
- термины и определения (при необходимости);
- содержание инструкции (для инструкций большого объема);
c) основное содержание инструкции в форме пронумерованной последовательности действий с указанием требуемых материалов, оборудования, приборов и документации;
d) прочие данные, например, периодичность обработки оборудования и помещений и пр.;
e) фамилии, инициалы и должности;
- разработчиков инструкции;
- лиц, согласовавших и утвердивших инструкцию;
f) приложения к инструкции.
Инструкция может иметь титульный лист, на котором указываются:
- наименование предприятия.
- наименование подразделения;
- наименование инструкции,
- номер инструкции,
- дата утверждения инструкции,
- дата и номер внесения изменения (при необходимости),
- срок действия инструкции.
- разработчик инструкции,
- фамилии, инициалы и должности лиц, согласовавших и утвердивших инструкцию.
При наличии в инструкции графиков (рисунков) и таблиц они должны иметь сквозную нумерацию и наименования.
Лица, указанные в перечислении Ь), должны пройти обучение работе поданной инструкции.
При разработке инструкции рекомендуется готовить учебно-методический материал, который может прилагаться к инструкции.
5
ГОСТ Р 52550-2006
5.5.3 Форма представления инструкции
Форма представления инструкции определяется самим предприятием В пределах одного предприятия следует использовать единую форму. Пример формы инструкции приведен в приложении F.
5.5.4 Порядок разработки, согласования и утверждения инструкций
Инструкция разрабатывается компетентным сотрудником. Данный сотрудник может входить или не входить в перечень лиц, на которые будет распространяться инструкция.
Разработка инструкции ведется в следующем порядке:
- получение номера разрабатываемой инструкции в отделе, контролирующем ведение документации;
- разработка проекта инструкции;
- обсуждение инструкции и работа в соответствии с ней в опытном порядке с участием тех, кто будет по ней работать; при этом особое внимание следует уделять полноте инструкции и ясности ее изложения;
- доработка инструкции с учетом предложений и замечаний;
- повторное обсуждение инструкции (при необходимости);
- проверка необходимости изменения других документов в случае утверждения данной инструкции (при внесении изменений в инструкцию — проверка необходимости изменений других разделов данной инструкции или других документов);
- согласование инструкции с соответствующими службами (отделами), в том числе службой контроля качества и подразделением, ответственным за ведение документации;
- утверждение инструкции;
- помещение инструкции в электронную базу данных предприятия (если это предусмотрено):
- изготовление необходимого числа копий инструкции с указанием номера копии инструкции и постановка их на учет;
- обучение персонала сразу же после утверждения инструкции.
5.5.5 Порядок представления и хранения инструкций
Инструкции могут быть представлены в бумажном и(или) в электронном виде.
Доступ к инструкциям в электронной форме должны иметь все лица, на которые они распространяются, соответствующие руководители и сотрудники подразделений.
Оригиналы (контрольные экземпляры) хранятся в отделе обеспечения качества или другом подразделении. ответственном за контроль ведения документации.
Пользователь может иметь только действующие учтенные копии, не допускается нахождение у пользователя проектов документов.
Проекты документов должны иметь гриф «ПРОЕКТ».
Подразделение, контролирующее ведение документации, должно следить за недопущением дублирования инструкций и противоречий в инструкциях, привлекая для этого необходимые подразделения.
5.5.6 Пересмотр и внесение изменений
Инструкции должны периодически пересматриваться по истечении срока их действия, но не реже одного раза в два года. При изменениях 8 оборудовании или процессе вносятся изменения во все инструкции, имеющие к ним отношение.
Рекомендуется ввести электронную систему контроля ведения документации, предупреждающую об окончании срока действия документа и необходимости его пересмотра или внесения изменений.
5.6 Протокол на серию
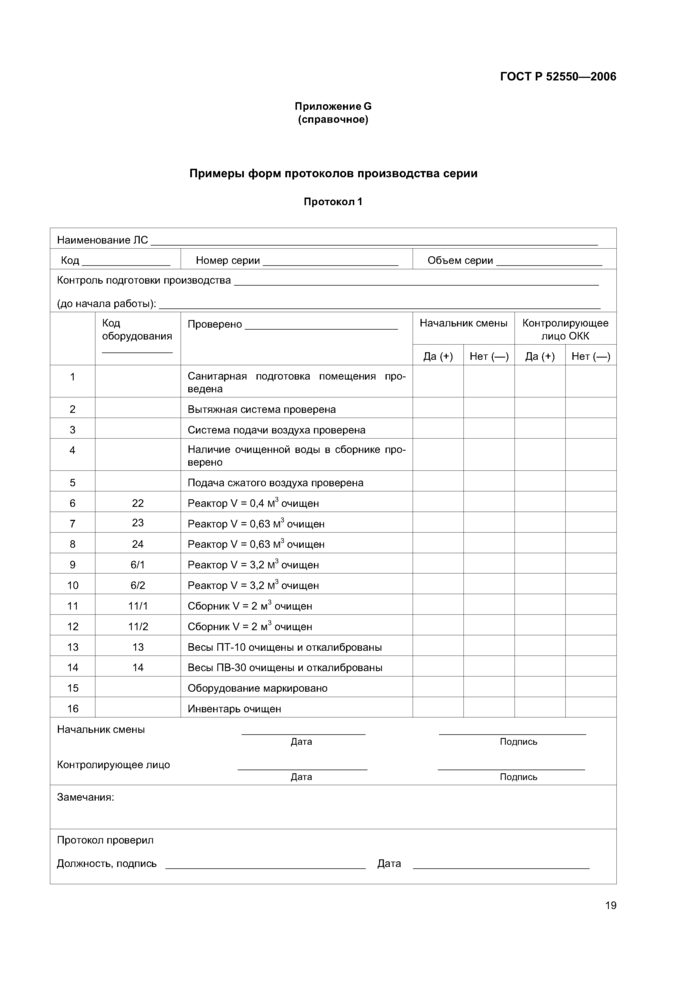
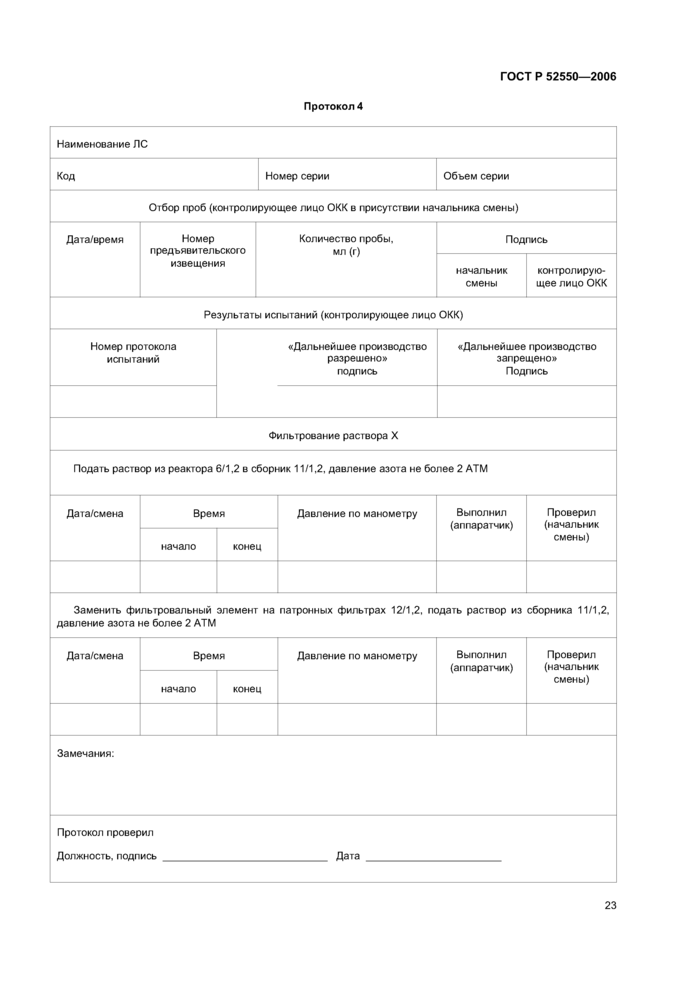
5.6.1 При разработке технологической документации необходимо предусматривать порядок регистрации хода выполнения операций и получаемых результатов, а также заверения подписями полученных данных. Для этого на предприятии рекомендуется разрабатывать формы документов с изготовлением. при необходимости, бланков для внесения данных (записей) при выполнении операций.
Содержание протоколов на производство серий и протоколов на упаковку серий должно соответствовать промышленному регламенту, технологическим инструкциям и инструкциям на упаковку.
При необходимости бланки для внесения данных (записей) помещают в инструкции в виде приложений.
5.6.2 Такие бланки должны содержать наименования операций (оборудования, параметров и пр.) и графы для регистрации выполнения операций, состояния оборудования, значений параметров и т.д.
Бланки для внесения данных (записей), при необходимости, должны содержать указания по проведению вычислений (см. приложение G).
Бланки следует составлять таким образом, чтобы можно было сравнивать полученные результаты с нормами, указанными в спецификациях и других документах. Они должны содержать указание о необходимости внесения записей в случае отклонений.
6