ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫМ
СТАНДАРТ
РОССИЙСКОЙ
ФЕДЕРАЦИИ
Стерилизация медицинских изделийТРЕБОВАНИЯ К МЕДИЦИНСКИМ ИЗДЕЛИЯМ КАТЕГОРИИ «СТЕРИЛЬНЫЕ»
Часть 1
Требования к медицинским изделиям, подлежащим финишной стерилизации
EN 556-1:2001
Sterilization of medical devices — Requirements for medical devices to be designated STERILE — Part 1: Requirements for terminally sterilized medical
devices
(IDT)
Издание официальное
CM
5
s
1
2
Москва Стандарти нформ 2011
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации — ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Фармстер» (ООО «Фармстер») на основе перевода на русский язык стандарта, указанного в пункте 4, который выполнен институтом «Биофизика»
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 383 «Стерилизация медицинской продукции»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 2 декабря 2009 г. № 530-ст
4 Настоящий стандарт идентичен европейскому стандарту ЕН 556-1:2001 «Стерилизация медицинских изделий. Требования к медицинским изделиям категории «стерильные». Часть 1. Требования к медицинским изделиям, подлежащим финишной стерилизации» (EN 556-1:2001 «Sterilization of medical devices — Requirements for medical devices to be designated STERILE — Part 1: Requirements for terminally sterilized medical devices»), включая изменения AC:2006.
Изменения к указанному международному стандарту, принятые после его официальной публикации, внесены в текст настоящего стандарта и выделены двойной вертикальной линией, расположенной на полях от соответствующего текста, а обозначение и год принятия изменения приведены в скобках после соответствующего текста.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие или национальные стандарты Российской Федерации, сведения которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
© Стандартинформ, 2011
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
II
Редактор В.Н. Копысов Технический редактор В.Н. Прусакова Корректор В.Е. Нестерова Компьютерная верстка В.И. Гоищенко
Сдано в набор 28.12.2010. Подписано в печать 19.01.2011. Формат бОхв^/в. Бумага офсетная. Гарнитура Ариал. Печать офсетная. Уел. печ. л. 1,40. Уч.-изд. л. 1,25. Тираж 101 экз. За к. 22.
ФГУП «СТАНДАРТИНФОРМ», 123995 Москва, Гранатный пер., 4. www.gostinfo.ru info@gostinfo.ru Набрано во ФГУП «СТАНДАРТИНФОРМ» на ПЭВМ.
Отпечатано в филиале ФГУП «СТАНДАРТИНФОРМ» — тип. «Московский печатник», 105062 Москва, Лялин пер., 6.
ГОСТ Р ЕН 556-1-2009
Содержание
1 Область применения............................................1
2 Нормативные ссылки............................................1
3 Термины и определения..........................................1
4 Требования.................................................2
Приложение ZA (справочное) Разделы настоящего стандарта, касающиеся основных требований
или иных положений Директив Европейского Союза..................3
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов
ссылочным национальным стандартам Российской Федерации............4
Библиография.................................................5
Введение
Стерильным считается такой продукт, в котором отсутствуют жизнеспособные микроорганизмы. В случае необходимости поставки стерильного продукта в европейских стандартах содержится требование, чтобы случайное микробиологическое загрязнение из всех источников было сведено к минимуму всеми возможными способами. Тем не менее, продукция, произведенная при стандартизированных условиях в соответствии с требованиями системы качества, относящимися к медицинским изделиям (см. ЕН ИСО 13485:2000 или ЕН ИСО 13488:2000), может до стерилизации нести в себе микроорганизмы даже в малых количествах. Целью процесса стерилизации является умерщвление (гибель) патогенных и непатогенных микроорганизмов и, таким образом, превращение нестерильных изделий в стерильные.
Инактивация культуры микроорганизмов посредством физического и/или химического агентов, используемая для стерилизации медицинских изделий, часто почти полностью соответствует экспоненциальной зависимости. Это означает, что всегда существует конечная вероятность того, что какой-либо микроорганизм останется жизнеспособным независимо от объема используемой стерилизационной обработки. Для каждой отдельно взятой обработки вероятность выживания микроорганизмов зависит от числа и устойчивости микроорганизмов, а также среды, в которой последние находятся во время обработки. Из этого следует, что нельзя гарантировать отсутствие жизнеспособных микроорганизмов на (в) любом изделии, подвергнутом стерилизационной обработке. Стерильность обработанных изделий должна быть выражена в единицах вероятности выживания микроорганизмов на (в) изделиях. В стандартах на менеджмент систем качества признается, что существуют такие процессы, качество которых не может быть проверено последующим контролем и испытанием продукта. Стерилизация — это пример такого процесса. Процессы стерилизации должны пройти валидацию перед использованием. Их эффективность должна регулярно контролироваться, а аппаратура — содержаться в рабочем состоянии.
Важно знать, что использование правильно валидированного и точно регулированного процесса стерилизации — не единственный фактор, гарантирующий стерильность продукции, а также возможность ее применения по назначению. Необходимо обратить внимание на ряд факторов, включая микробиологическое состояние (бионагрузку) исходных материалов и/или введенных компонентов, условия их последующего хранения, а также на контроль среды, в которой продукт произведен, собран и упакован.
IV
ГОСТ Р ЕН 556-1-2009НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИСтерилизация медицинских изделий ТРЕБОВАНИЯ К МЕДИЦИНСКИМ ИЗДЕЛИЯМ КАТЕГОРИИ «СТЕРИЛЬНЫЕ»Часть 1Требования к медицинским изделиям, подлежащим финишной стерилизации
Sterilization of medical devices. Requirements for medical devices to be designated «sterile».
Part 1. Requirements for terminally sterilized medical devices
Дата введения — 2011—01—01
1 Область применения
Настоящий стандарт устанавливает требования к медицинским изделиям, прошедшим финишную стерилизацию, которые будут отнесены к категории «СТЕРИЛЬНЫЕ». ЕН 556-2 устанавливает требования к медицинским изделиям, обработанным в асептических условиях, которые будут отнесены к категории «СТЕРИЛЬНЫЕ».
Примечание — В рамках Директивы Европейского Союза, касающейся медицинских изделий (см. библиографию), обозначение медицинских изделий «СТЕРИЛЬНЫЕ» допускается лишь только тогда, когда применяется валидированный процесс стерилизации. Требования к валидации и текущему контролю процессов стерилизации медицинских изделий установлены в ЕН 550, ЕН 552, ЕН 554, ЕН ИСО 14160 и ЕН ИСО 14937.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие международные стандарты*:
ЕН ИСО 13485:2000 Системы качества. Медицинские изделия. Частные требования по применению стандарта ЕН/ИСО 9001 (измененная редакция ЕН 46001:1996) (идентичен стандарту ИСО 13485:1996) (Quality systems — Medical devices — Particular requirements for the application of EN/ISO 9001 (revision of EN 46001:1996) (identical to ISO 13485:1996)
EH ИСО 13488:2000 Системы качества. Медицинские изделия. Частные требования по применению стандарта ЕН/ИСО 9002 (измененная редакция ЕН 46002:1996) (идентичен стандарту ИСО 13488:1996) (Quality systems — Medical devices — Particular requirements for the application of EN/ISO 9002 (revision of EN 46002:1996) (identical to ISO 13488:1996)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
Примечание — Термины, определения которым даны в настоящем разделе, выделены в тексте настоящего стандарта курсивом.
3.1 бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на продукте и/или упаковке.
* Для датированных ссылок используют только указанное издание стандарта. В случае недатированных ссылок— последнее издание стандарта, включая все изменения и поправки.
Издание официальное
3.2 медицинское изделие (medical device): Любой инструмент, аппарат, устройство, материал или иное изделие, которые, будучи использованы самостоятельно или в комбинации друг с другом, включая программное обеспечение, необходимое для их правильного применения, предназначено изготовителем для использования в целях:
- диагностики, профилактики, мониторинга, лечения или облегчения заболевания;
- диагностики, мониторинга, лечения, облегчения или компенсации травмы или иного физического недостатка;
- изучения, замены, модификации анатомии или физиологического процесса;
- контроля зачатия.
Действие медицинского изделия внутри или снаружи тела человека достигается без применения фармакологических, иммунологических или метаболических средств, однако подобные средства могут использоваться при применении изделий.
3.3 стерильность (sterility): Состояние, при котором отсутствуют жизнеспособные микроорганизмы.
3.4 стерильный (sterile): Состояние медицинского изделия, при котором отсутствуют жизнеспособные микроорганизмы.
3.5 прошедший финишную стерилизацию (terminally-sterilized): Состояние медицинского изделия, которое подверглось процедуре стерилизации в своей упаковке и собранном виде, что позволяет поддерживать стерильность медицинского изделия, подвергнутого процессу стерилизации.
4 Требования
4.1 Для того, чтобы медицинские изделия, прошедшие финишную стерилизацию, могли быть отнесены к категории «СТЕРИЛЬНЫЕ», необходимо, чтобы вероятность присутствия в (на) них жизнеспособных микроорганизмов была менее или равна 1 х 10-6.
Примечание — Показатель вероятности, превышающий данные, указанные в настоящем разделе, может быть разрешен компетентными регулирующими органами. Такое утверждение зависит от конкретной ситуации, в том числе разрешение должно учитывать особые случаи, включая анализ рисков, проведенный производителем медицинского изделия (см., например, ЕН ИСО 14971) (АС:2006).
4.2 Соответствие изделий требованиям настоящего стандарта должно быть установлено производителем или поставщиком посредством предоставления документов и записей показателей, доказывающих, что изделия были подвергнуты валидированному процессу стерилизации, отвечающему требованиям 4.1.
Документация и записи показателей должны храниться согласно процедуре, указанной в ЕН ИСО 13485, подразделы 4.5 и 4.16, или ЕН ИСО 13488, подразделы 4.5 и 4.16.
Примечание 1 — Стерильность медицинского изделия доказывается:
1) предварительной валидацией процесса стерилизации и последующими ревалидациями, показывающими, что данный процесс приемлем;
2) информацией, собранной во время текущего контроля и мониторинга процесса, показывающей, что вали-дированный процесс был эффективно применен.
Примечание 2 — Стерильность медицинского изделия определяется уровнем бионагрузки на изделиях, устойчивостью микроорганизмов, составляющих данную бионагрузку, и установленной продолжительностью обработки во время стерилизации.
2
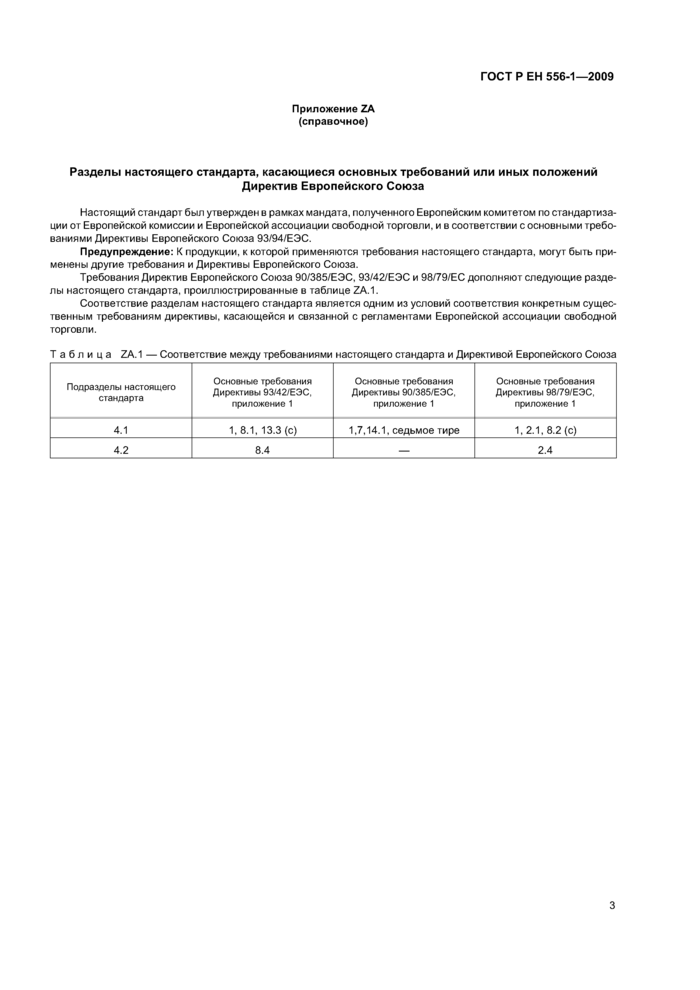
Приложение ZA (справочное)
Разделы настоящего стандарта, касающиеся основных требований или иных положений
Директив Европейского Союза
Настоящий стандарт был утвержден в рамках мандата, полученного Европейским комитетом по стандартизации от Европейской комиссии и Европейской ассоциации свободной торговли, и в соответствии с основными требованиями Директивы Европейского Союза 93/94/ЕЭС.
Предупреждение: К продукции, к которой применяются требования настоящего стандарта, могут быть применены другие требования и Директивы Европейского Союза.
Требования Директив Европейского Союза 90/385/ЕЭС, 93/42/ЕЭС и 98/79/ЕС дополняют следующие разделы настоящего стандарта, проиллюстрированные в таблице ZA.1.
Соответствие разделам настоящего стандарта является одним из условий соответствия конкретным существенным требованиям директивы, касающейся и связанной с регламентами Европейской ассоциации свободной торговли.
|
Таблица ZA.1 — Соответствие между требованиями настоящего стандарта и Директивой Европейского Союза |
|
Подразделы настоящего стандарта |
Основные требования Директивы 93/42/ЕЭС, приложение 1 |
Основные требования Директивы 90/385/ЕЭС, приложение 1 |
Основные требования Директивы 98/79/ЕЭС, приложение 1 |
|
4.1 |
1, 8.1, 13.3 (с) |
1,7,14.1, седьмое тире |
1,2.1, 8.2 (с) |
|
4.2 |
8.4 |
— |
2.4 |
|
3
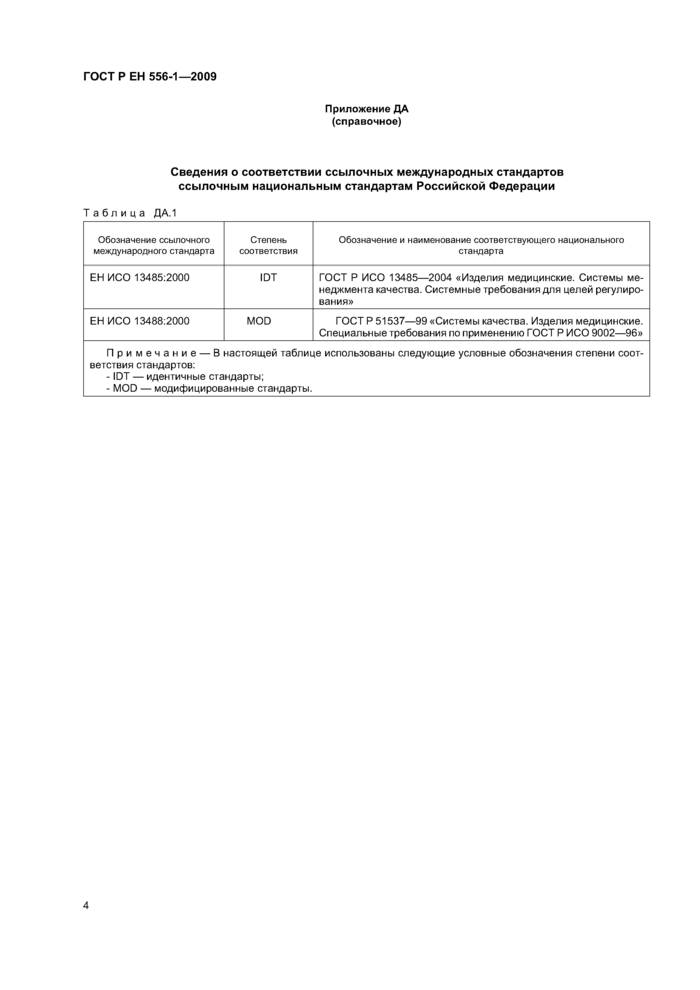
Приложение ДА (справочное)
Сведения о соответствии ссылочных международных стандартов ссылочным национальным стандартам Российской Федерации
|
Таблица ДА.1 |
|
Обозначение ссылочного международного стандарта |
Степень
соответствия |
Обозначение и наименование соответствующего национального стандарта |
|
ЕН ИСО 13485:2000 |
ЮТ |
ГОСТ Р ИСО 13485-2004 «Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования» |
|
ЕН ИСО 13488:2000 |
MOD |
ГОСТ Р 51537-99 «Системы качества. Изделия медицинские. Специальные требования по применению ГОСТ Р ИСО 9002-96» |
|
Примечание — В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов:
- ЮТ — идентичные стандарты;
- MOD — модифицированные стандарты. |
|
4
ГОСТ Р ЕН 556-1-2009
[1] ЕН ИСО 9001:1994
[2] ЕН ИСО 9002:1994
[3] ЕН 550
[4] ЕН 552
[5] ЕН 554
[6] ЕН 980
[7] ЕН 14971
[8] ЕН ИСО 14160:1998
[9] ЕН ИСО 14937:2000
[10] 90/385/ЕЭС
[11] 93/42/ЕЭС
[12] 98/79/ЕЭС
Библиография
Системы качества. Модель для обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
(EN ISO 9001:1994 Quality systems — Model for quality assurance in design/development, production, installation and servicing)*
Системы контроля качества. Модель для обеспечения качества при производстве, монтаже и обслуживании
(EN ISO 9002:1994 Quality systems — Model for quality assurance in production, installation and servicing)*
Стерилизация медицинских изделий. Валидация и текущий контроль стерилизации окисью этилена
(EN 550 Sterilization of medical devices—Validation and routine control of ethylene oxide sterilization)*
Стерилизация медицинских изделий. Валидация и текущий контроль радиационной стерилизации
(EN 552 Sterilization of medical devices — Validation and routine control of sterilization irradiation)*
Стерилизация медицинских изделий. Валидация и текущий контроль стерилизации водяным паром
(EN 554 Sterilization of medical devices — Validation and routine control of sterilization moist heat)*
Графические символы, используемые для маркировки медицинских изделий (EN 980 Graphical symbols for use in the labeling of medical devices)*
Устройства медицинские. Применение системы управления рисками к медицинским устройствам (АС:2006) [EN 14971 Medical devices — Application of risk management to medical devices (ISO 14971:2007)]*
Стерилизация одноразовых медицинских изделий. Валидация и текущий контроль стерилизации жидкими химическими стерилизующими веществами
(EN ISO 14160:1998 Sterilization of single-use medical devices incorporating materials of animal origin — Validation and routine control of sterilization by liquid chemical sterilants)* Стерилизация медицинской продукции. Общие требования для определения характеристик стерилизующего вещества и для разработки, валидации и текущего контроля процесса стерилизации
(EN ISO 14937:2000 Sterilization of health care products — General requirements for characterization of a sterilizing agent and development, and routine control of a sterilization process for medical devices)*
Консульская Директива от 20 июня 1990 г. по соответствию законодательств госу-дарств-участников, касающаяся активных имплантируемых медицинских изделий (90/385/ЕЕС Council Directive of 20 June 1990 on the approximation the laws of the Member States relating to active implantable medical devices)*
Консульская Директива от 14 июня 1993 г. о медицинских изделиях [O.J.L 169 1.43 (12 июля 1993)]
[93/42/ЕЕС Council Directive of 14 June 1993 concerning medical devices (O.J.L pp. 169 1.43 (12 July 1993)]*
Консульская Директива от 27 октября 1998 г. по in vitro диагностическим медицинским изделиям
(98/79/ЕЕС Council Directive of 27 October 1998 on in vitro diagnostic medical devices)*
Официальный перевод данного стандарта находится в Федеральном информационном фонде.
5
УДК 615.478.73:006.345 ОКС 11.080 Р26 ОКП 94 5120
Ключевые слова: стерилизация, медицинские изделия, категория «стерильные»
6